-
原子 编辑
中文名:原子
化学名:atom
物理名:atomy
定义:化学反应不可再分的基本微粒
性质:永不停息地做无规则运动
每一个放射性同位素都有一个特征衰变期间,即半衰期。半衰期就是一半样品发生衰变所需要的时间。这是一种指数衰变,即样品在每一个半衰期内恒定的衰变50%,换句话说,当两次半衰期之后,就只剩下25%的起始同位素了。
磁矩
基本微粒都有一个固有性质,就像在宏观物理中围绕质心旋转的物体都有角动量一样,在量子力学中被叫做自旋。但是严格来说,这些微粒仅仅是一些点,不能够旋转。自旋的单位是约化普朗克常数,电子、质子和中子的自旋都是½。在原子里,电子围绕原子核运动,所以除了自旋,它们还有轨道角动量。而对于原子核来说,轨道角动量是起源于自身的自旋。
正如一个旋转的带电物体能够产生磁场一样,一个原子所产生的磁场,即它的磁矩,就是由这些不同的角动量决定的。然后,自旋对它的影响应该是最大的。因为电子的一个性质就是要符合泡利不相容原理,即不能有两个位于同样量子态的电子,所以当电子成对时,总是一个自旋朝上而另外一个自旋朝下。这样,它们产生的磁场相互抵消。对于某些带有偶数个电子的原子,总的磁偶极矩会被减少至零。
对于铁磁性的元素,例如铁,因为电子总数为奇数,所以会产生一个净磁矩。同时,因为相邻原子轨道重叠等原因,当未成对电子都朝向同一个方向时,体系的总能量最低,这个过程被称为交换相互作用。当这些铁磁性元素的磁动量都统一朝向后,整个材料就会拥有一个宏观可以测量的磁场。顺磁性材料中,在没有外部磁场的情况下,原子磁矩都是随机分布的;施加了外部磁场以后,所有原子都会统一朝向,产生磁场。
原子核也可以存在净自旋。由于热平衡,通常这些原子核都是随机朝向的。但对于一些特定元素,例如氙-129,一部分核自旋也是可能被极化的,这个状态被叫做超极化,在核磁共振成像中有很重要的应用。
能级
原子中,电子的势能与它离原子核的距离成反比。测量电子的势能,通常的测量将让该电子脱离原子所需要的能量,单位是电子伏特(eV)。在量子力学模型中,电子只能占据一组以原子核为中心的状态,每一个状态就对应于一个能级。最低的能级就被叫做基态,而更高的能级就被叫做激发态。
电子要在两个能级之间跃迁的前提是它要吸收或者释放能量,该能量还必须要和这两个能级之间的能量差一致。因为释放的光子能量只与光子的频率有关,并且能级是不连续的,所以在电磁波谱中就会出现一些不连续的带。每一个元素都有一个特征波谱,特征波谱取决于核电荷的多少,电子的填充情况,电子间的电磁相互作用以及一些其他的因素。
当一束全谱的光经过一团气体或者一团等离子体后,一些光子会被原子吸收,使得这些原子内的电子跃迁。而在激发态的电子则会自发的返回低能态,能量差作为光子被释放至一个随机的方向。前者就使那些原子有了类似于滤镜的功能,观测者在最后接收到的光谱中会发现一些黑色的吸收能带。而后者能够使那些与光线不在同一条直线上的观察者观察到一些不连续的谱线,实际就是那些原子的发射谱线。对这些谱线进行光谱学测量就能够知道该物质的组成以及物理性质。在对谱线进行了细致的分析后,科学家发现一些谱线有着精细结构的裂分。这是因为自旋与最外层电子运动间的相互作用,也被称作自旋-轨道耦合。当原子位于外部磁场中时,谱线能够裂分成三个或多个部分,这个现象被叫做塞曼效应,其原因是原子的磁矩及其电子与外部磁场的相互作用。一些原子拥有许多相同能级电子排布,因而只产生一条谱线。当这些原子被安置在外部磁场中时,这几种电子排布的能级就有了一些细小的区别,这样就出现了裂分。外部电场的存在也能导致类似的现象发生,被称为斯塔克效应。
如果一个电子在激发态,一个有着恰当能量的光子能够使得该电子受激辐射,释放出一个拥有相同能量的光子,其前提就是电子返回低能级所释放出来的能量必须要与与之作用的光子的能量一致。此时,受激释放的光子与原光子向同一个方向运动,也就是说这两个光子的波是同步的。利用这个原理,人们设计出了激光,用来产生一束拥有很窄频率相干光源。
态
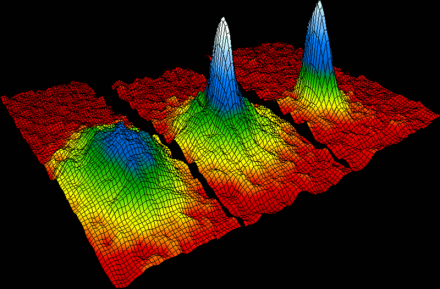
物质很多不同的相态之中都存在原子,这些相态都由一定的物理条件所决定,例如温度与压强。通过改变这些条件,物质可以在固体、液体、气体与等离子体之间转换。在同一种相态中,物质也可以有不同的形态,例如固态的碳就有石墨和金刚石两种形态。当温度很靠近绝对零度时,原子可以形成玻色-爱因斯坦凝聚态。这些超冷的原子可以被视为一个超原子,使得科学家可以研究量子力学的一些基本原理。
质量数
(mass number)由于质子与中子的质量相近且远大于电子,所以用原子的质子和中子数量的总和定义相对原子质量,称为质量数。
相对原子质量
原子的静止质量通常用统一原子质量单位(u)来表示,也被称作道尔顿(DA)。这个单位被定义为电中性的碳12质量的十二分之一,约为1.66×10⁻²⁷kg。氢最轻的一个同位素氕是最轻的原子,重量约为1.007825u。一个原子的质量约是质量数与原子质量单位的乘积。最重的稳定原子是铅-208,质量为207.9766521u。
摩尔(mole)
就算是最重的原子,化学家也很难直接对其进行操作,所以它们通常使用另外一个单位摩尔。摩尔的定义是对于任意一种元素,一摩尔总是含有同样数量的原子,约为6.022×10²³个【2010年CODATA数据:
核合成
稳定的质子和电子在大爆炸后的一秒钟内出现。在接下来的三分钟之内,太初核合成产生了宇宙中大部分的氦、锂和氘,有可能也产生了一些铍和硼。在理论上,最初的原子(有束缚的电子)是在大爆炸后大约380,000 年产生的,这个时代称为重新结合,在这时宇宙已经冷却到足以使电子与原子核结合了。自从那时候开始,原子核就开始在恒星中通过核聚变的过程结合,产生直到铁的元素。
像锂-6那样的同位素是在太空中通过宇宙射线散裂产生的。这种现象在高能量的质子撞击原子核时会发生,造成大量核子被射出。比铁重的元素在超新星中通过r-过程产生,或在AGB星中通过s-过程产生,两种过程中都有中子被原子核捕获。像铅那样的元素,大都是从更重的元素通过核衰变产生的。
地球
大部分组成地球及其居民的原子,都是在太阳系刚形成的时候就已经存在了。还有一部分的原子是核衰变的结果,它们的相对比例可以用来通过放射性定年法决定地球的年龄。大部分地壳中的氦都是α衰变的产物。
地球上有很少的原子既不是在一开始就存在的,也不是放射性衰变的结果。碳-14是大气中的宇宙射线所产生的。有些地球上的原子是核反应堆或核爆炸的产物,要么是特意制造的,要么是副产物。在所有超铀元素──原子序数大于92的元素中,只有钚和镎在地球中自然出现。超铀元素的寿命比地球的年龄短,因此许多这类的元素都早已衰变了,只有微量的钚-244例外。钚和镎的自然矿藏是在铀矿中通过中子俘获产生的。
地球含有大约1.33x10E50个原子。在地球的大气层中,含有少量的惰性气体原子,例如氩和氖。大气层剩下的99%的部分,是以分子的形式束缚的,包括二氧化碳、双原子的氧气和氮气。在地球的表面上,原子结合并形成了各种各样的化合物,包括水、盐、硅酸盐和氧化物。原子也可以结合起来组成不含独立分子的物质,包括晶体和液态或固态金属。
罕见和理论形式
虽然原子序数大于82(铅)的元素已经知道是放射性的,但是对于原子序数大于103的元素,提出了“稳定岛”的概念。在这些超重元素中,可能有一个原子核相对来说比其它原子核稳定。最有可能的稳定超重元素是Ubh,它有126 个质子和184 个中子。
每一个粒子都有一个对应的反物质粒子,电荷相反。因此,正电子就是带有正电荷的反电子,反质子就是与质子对等,但带有负电荷的粒子。不知道什么原因,在宇宙中反物质是非常稀少的,因此在自然界中没有发现任何反原子。然而,1996年,在日内瓦的欧洲核子研究中心,首次合成了反氢──氢的反物质。
把原子中的质子、中子或电子用相等电荷的其它粒子代替,可以形成奇异原子。例如,可以把电子用质量更大的μ子代替,形成μ子原子。这些类型的原子可以用来测试物理学的基本预言。
原子没有一个精确定义的最外层,通常所说的原子半径是根据相邻原子的平均核间距测定的。
共价半径
我们测得氯气分子中两个Cl原子的核间距为1.988Α,就把此核间距的一半,即0.994Α定为氯原子的半径,此半径称为共价半径。共价半径为该元素单质键长的一半。
金属半径
另外,我们也可以测得金属单质比如铜中相邻两个铜原子的核间距,其值的一半称为金属半径 。
范德华半径
指在分子晶体中,分子间以范德华力结合,如稀有气体相邻两原子核间距的一半。
下表为一些元素的原子半径(pm),数据取自《无机化学-第四版》(2000年 )和j.chem.phys(1967)。
元素 | 氢 | 氦 | 锂 | 铍 | 硼 | 碳 | 氮 | 氧 | 氟 | 氖 |
半径 | 37 | 122 | 152 | 111 | 88 | 77 | 70 | 66 | 64 | 160 |
元素 | 镁 | 铝 | 硅 | 磷 | 氯 | 氩 | 钾 | |||
半径 | 186 | 160 | 143 | 117 | 110 | 104 | 99 | 191 | 227 | 197 |
元素 | 钪 | 钛 | 钒 | 铬 | 铁 | 镍 | 铜 | |||
半径 | 161 | 145 | 132 | 125 | 124 | 124 | 125 | 125 | 128 | 133 |
元素 | 镓 | 锗 | 砷 | 溴 | 氪 | 铷 | 锶 | 钇 | 锆 | |
半径 | 122 | 122 | 121 | 117 | 114 | 198 | 248 | 215 | 181 | 160 |
元素 | 铌 | 锝 | 钌 | 铑 | 钯 | 银 | 镉 | 铟 | 锡 | |
半径 | 143 | 136 | 136 | 133 | 135 | 138 | 144 | 149 | 163 | 141 |
元素 | 锑 | 碲 | 氙 | 铯 | 钡 | |||||
半径 | 141 | 137 | 133 | 217 | 265 | 217 |
注:表中非金属元素为共价半径、金属元素为金属半径、稀有气体为范德华半径
注:许多元素的半径值在不同书籍中差异较大,其原因有:
①原子半径的单位有(pm)和埃(Α)两种,Α=100pm。
②原子半径的测定方法不同。
③原子半径的种类不同。
原子半径的周期规律
在元素周期表中,原子的半径变化的大体趋势是自上而下增加,而从左至右减少。因此,最小的原子是氢,半径为0.28Α;最大的原子是铯,半径为2.655Α。因为这样的尺寸远远小于可见光的波长(约400~700nm),所以不能够通过光学显微镜来观测它们。然而,使用扫描隧道显微镜,我们能够观察到单个原子。
概述
电子是一种带电体,正如所有带电体一样,电子旋转时会产生一个磁场,因此,不同的原子往往有不同的磁学特性。
分子轨道理论可以很好地解释分子的磁性问题,例如氧气的顺磁性 。
逆磁性
一些物质的原子中电子磁矩互相抵消,合磁矩为零。当受到外加磁场作用时,电子轨道运动会发生变化,而且在与外加磁场的相反方向产生很小的合磁矩。常见的逆磁性金属有Bi、Cu、Ag、Au。
顺磁性
顺磁性物质的主要特点是原子或分子中含有没有完全抵消的电子磁矩,因而具有原子或分子磁矩。但是原子磁矩之间并无强的相互作用(一般为交换作用),因此原子磁矩在热骚动的影响下处于无规(混乱)排列状态,原子磁矩互相抵消而无合磁矩。但是当受到外加磁场作用时,这些原来在热骚动下混乱排列的原子磁矩便同时受到磁场作用使其趋向磁场排列和热骚动作用使其趋向混乱排列,因此总的效果是在外加磁场方向有一定的磁矩分量。这样便使磁化率(磁化强度与磁场强度之比)成为正值,但数值也是很小,一般顺磁物质的磁化率约为十万分之一(10⁻⁵),并且随温度的降低而增大。
常见的顺磁性物质有:氧气、一氧化氮、铂。
核性质
放射性
某些物质的原子核能发生衰变,放出我们肉眼看不见也感觉不到的射线,只能用专门的仪器才能探测到的射线。物质的这种性质叫放射性。
衰变
不稳定(即具有放射性)的原子核在放射出粒子及能量后可变得较为稳定,这个过程称为衰变(RadioaCTive decay)。这些粒子或能量(后者以电磁波方式射出)统称辐射(radiation)。由不稳定原子核发射出来的辐射可以是α(氦原子核)粒子、β(电子或正电子)粒子、γ射线或中子。
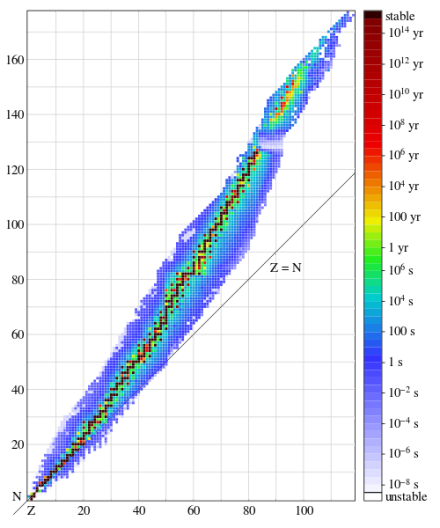
放射性核素在衰变过程中,该核素的原子核数目会逐渐减少。衰变至只剩下原来质量一半所需的时间称为该核素的半衰期(half-life)。每种放射性核素都有其特定的半衰期,由几微秒到几百万年不等。
原子核由于放出某种粒子而变为新核的现象.原子核是一个量子体系,核衰变是原子核自发产生的变化,它是一个量子跃迁过程,它服从量子统计规律.对任何一个放射性核素,它发生衰变的精确时刻是不能预知的,但作为一个整体,衰变的规律十分明确.若在dt时间间隔内发生核衰变的数目为dN,它必定正比于当时存在的原子核数目N,显然也正比于时间间隔dt。
衰变有3种:α衰变 、β衰变和γ衰变。
核裂变(nuclear fission)
核裂变指是一个原子核分裂成几个原子核的变化,核裂变通常由中子轰击质量数较大的原子核引起,原子核裂变后会形成两个质量相当的部分,并放出能量,有时会导致链式反应的发生。能量=质量╳光速的平方
核聚变
核聚变是指由质量小的原子,主要是指氘或氚,在一定条件下(如超高温和高压),发生原子核互相聚合作用,生成新的质量更重的原子核,并伴随着巨大的能量释放的一种核反应形式。原子核中蕴藏巨大的能量,原子核的变化(从一种原子核变化为另外一种原子核)往往伴随着能量的释放。
如果是由重的原子核变化为轻的原子核,叫核裂变,如原子弹爆炸;如果是由轻的原子核变化为重的原子核,叫核聚变,如太阳和氢弹。现在人类只能和平利用核裂变,不能和平利用核聚变。
稳定性
原子核的稳定性,是指原子核不会自发地改变其质子数、中子数和它的基本性质。按原子核的稳定性可分为稳定原子核和不稳定(或放射性)原子核两类。
1.原子核中的质子数等于和大于84的原子核是不稳定的。即原子序数84以后的元素均为放射性元素。
2.具有少于84个质子的原子核,质子数和中子数均为偶数时,其核稳定。
3.质子数或中子数等于2,8,20,28,50,82,126的原子核特别稳定。这些数称为幻数。质子数和中子数都是幻数,称为双幻数核。
4.中子数和质子数之比n/p,在Z<20时n/p=1,原子核稳定。随着原子序数增加,n/p值增大,比值越大,稳定性越差。
原子核衰变
不稳定的原子核都会自发地转变成另一种核而同时放出射线,这种变化叫放射性衰变。原子核在衰变过程中放出的射线有三种:α射线、β射线和γ射线.
α射线是α粒子流,它是带正电的氦核。β射线是高速运动的电子流。
β衰变有β+和β-两种。β衰变时除放出正电子或负电子外,还放出中微子或反中微子。β-衰变是原子核内中子转变成质子(留在核内)同时放出一个电子和与电子相联系的反中微子。β+衰变是原子核内中子数较少,质子转变成中子(留在核内),同时放出一个正电子和一个中微子。
γ射线是光子流。通常是在α衰变或β衰变后形成新核时辐射出来的。这是因为放射性母核经上述衰变后,变成处于激发态的子核,子核在跃迁到正常态时,一般辐射出γ光子。
衰变前粒子的电荷总数和质量总数与衰变后所有粒子的电荷总数和质量总数相等
放射性衰变定律
t时刻样品中有N个核,在dt时间内有dN个发生衰变,有
t=0,N=N0,有
上式称为放射性衰变定律。
物理意义为:t时刻,每单位时间衰变的原子核数与该时刻原子核总数的比。越大,衰变越快。
习惯上常用半衰期来表征放射性元素衰变的快慢。半衰期的定义是:原子核衰变到N=N0/2所需的时间。用T表示。
有时也用平均寿命τ表示衰变的快慢。平均寿命是指每个原子核衰变前存在的时间的平均值。
放射性活度 (也称放射性强度)是指一个放射源,在单位时间内发生的核衰变次数。
在国际单位制中,放射性活度的单位是贝克勒尔(Bq)。1Bq表示每秒发生一次核衰变的放射源的活度。常用的单位还有居里(Ci)。
光谱
主条目:原子轨道
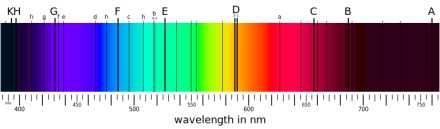
在稳定状态下,原子中的电子位于离核最近的轨道上,这时的原子就被称为基态原子;电子吸收能量后跃迁到更高的轨道上,这时原子就处于激发态。由于原子的轨道是量子化的,因此原子的能量发生变化时,会吸收(放出)特定的能量,产生不同的光谱图像,古斯塔夫·罗伯特·基尔霍夫(Gustav RobERT Kirchhoff)和罗伯特·威廉·本生(Robert Wilhelm Bunson)最早应用这一性质对不同元素的原子进行鉴定。
焰色反应(flame test)
当原子的光谱落在可见光区时,肉眼就可以看见不同的颜色,这是有些元素的原子在灼烧时引起火焰颜色变化的原因,这种变化被称为焰色反应,可以粗略地检测某些元素原子的存在。
下表给出部分金属(或金属离子)焰色反应产生的颜色:
类别 | 锂离子 | 铷离子 | 锶离子 | 钡离子 | ||||
颜色 | 紫红 | 黄 | 淡紫 | 紫 | 砖红 | 洋红 | 黄绿 | 绿 |
价电子
价电子是原子参与化学反应的电子数,价电子数与原子的化学性质密切相关,对于主族元素来说,价电子数等于其最外层电子数;对于副族元素,价电子数包括最外层电子数和次外层的d(有时还包括f)轨道的电子数,元素周期表中通常会用电子排布式标示一个特定元素的价电子。根据价电子的不同,元素周期表可以分为s区、p区、d区、ds区、f区 。
化合价
电离能
电离能的大小反映了原子失去电子的难易。电离能愈小,原子失去电子愈易,反之同理;电离能的大小和原子的有效电荷、原子半径和电子排布有很大关系。
第一电离能
基态气体原子失去电子成为带一个正电荷的气态正离子所需的能量称为第一电离能,一般来说,若不作说明,电离能即第一电离能。
1st~10th
以下是已发现所有元素的第一到第十电离能。数据来源不详。单位:kJ/mol(千焦/摩尔)
1st | 2nd | 3rd | 4th | 5th | 6th | 7th | 8th | 9th | 10th | |
氢 | 1312.0 | |||||||||
氦 | 2372.3 | 5250.5 | ||||||||
锂 | 520.2 | 7298.1 | 11815.0 | |||||||
铍 | 899.5 | 1757.1 | 14848.7 | 21006.6 | ||||||
硼 | 800.6 | 2427.1 | 3659.7 | 25025.8 | 32826.7 | |||||
碳 | 1086.5 | 2352.6 | 4620.5 | 6222.7 | 37831 | 47277.0 | ||||
氮 | 1402.3 | 2856 | 4578.1 | 7475.0 | 9444.9 | 53266.6 | 64360 | |||
氧 | 1313.9 | 3388.3 | 5300.5 | 7469.2 | 10989.5 | 13326.5 | 71330 | 84078.0 | ||
氟 | 1681.0 | 3374.2 | 6050.4 | 8407.7 | 11022.7 | 15164.1 | 17868 | 92038.1 | 106434.3 | |
氖 | 2080.7 | 3952.3 | 6122 | 9371 | 12177 | 15238 | 19999.0 | 23069.5 | 115379.5 | 131432 |
钠 | 495.8 | 4562 | 6910.3 | 9543 | 13354 | 16613 | 20117 | 25496 | 28932 | 141362 |
镁 | 737.7 | 1450.7 | 7732.7 | 10542.5 | 13630 | 18020 | 21711 | 25661 | 31653 | 35458 |
铝 | 577.5 | 1816.7 | 2744.8 | 11577 | 14842 | 18379 | 23326 | 27465 | 31853 | 38473 |
硅 | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16091 | 19805 | 23780 | 29287 | 33878 | 38726 |
磷 | 1011.8 | 1907 | 2914.1 | 4963.6 | 6273.9 | 21267 | 25431 | 29872 | 35905 | 40950 |
硫 | 999.6 | 2252 | 3357 | 4556 | 7004.3 | 8495.8 | 27107 | 31719 | 36621 | 43177 |
氯 | 1251.2 | 2298 | 3822 | 5158.6 | 6542 | 9362 | 11018 | 33604 | 38600 | 43961 |
氩 | 1520.6 | 2665.8 | 3931 | 5771 | 7238 | 8781 | 11995 | 13842 | 40760 | 46186 |
钾 | 418.8 | 3052 | 4420 | 5877 | 7975 | 9590 | 11343 | 14944 | 16963.7 | 48610 |
钙 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 | 10496 | 12270 | 14206 | 18191 | 20385 |
钪 | 633.1 | 1235.0 | 2388.6 | 7090.6 | 8843 | 10679 | 13310 | 15250 | 17370 | 21726 |
钛 | 658.8 | 1309.8 | 2652.5 | 4174.6 | 9581 | 11533 | 13590 | 16440 | 18530 | 20833 |
钒 | 650.9 | 1414 | 2830 | 4507 | 6298.7 | 12363 | 14530 | 16730 | 19860 | 22240 |
铬 | 652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 | 17820 | 20190 | 23580 |
锰 | 717.3 | 1509.0 | 3248 | 4940 | 6990 | 9220 | 11500 | 18770 | 21400 | 23960 |
铁 | 762.5 | 1561.9 | 2957 | 5290 | 7240 | 9560 | 12060 | 14580 | 22540 | 25290 |
钴 | 760.4 | 1648 | 3232 | 4950 | 7670 | 9840 | 12440 | 15230 | 17959 | 26570 |
镍 | 737.1 | 1753.0 | 3395 | 5300 | 7339 | 10400 | 12800 | 15600 | 18600 | 21670 |
铜 | 745.5 | 1957.9 | 3555 | 5536 | 7700 | 9900 | 13400 | 16000 | 19200 | 22400 |
锌 | 906.4 | 1733.3 | 3833 | 5731 | 7970 | 10400 | 12900 | 16800 | 19600 | 23000 |
镓 | 578.8 | 1979.3 | 2963 | 6180 | ||||||
锗 | 762 | 1537.5 | 3302.1 | 4411 | 9020 | |||||
砷 | 947.0 | 1798 | 2735 | 4837 | 6043 | 12310 | ||||
硒 | 941.0 | 2045 | 2973.7 | 4144 | 6590 | 7880 | 14990 | |||
溴 | 1139.9 | 2103 | 3470 | 4560 | 5760 | 8550 | 9940 | 18600 | ||
氪 | 1350.8 | 2350.4 | 3565 | 5070 | 6240 | 7570 | 10710 | 12138 | 22274 | 25880 |
铷 | 403.0 | 2633 | 3860 | 5080 | 6850 | 8140 | 9570 | 13120 | 14500 | 26740 |
锶 | 549.5 | 1064.2 | 4138 | 5500 | 6910 | 8760 | 10230 | 11800 | 15600 | 17100 |
钇 | 600 | 1180 | 1980 | 5847 | 7430 | 8970 | 11190 | 12450 | 14110 | 18400 |
锆 | 640.1 | 1270 | 2218 | 3313 | 7752 | 9500 | ||||
铌 | 652.1 | 1380 | 2416 | 3700 | 4877 | 9847 | 12100 | |||
钼 | 684.3 | 1560 | 2618 | 4480 | 5257 | 6640.8 | 12125 | 13860 | 15835 | 17980 |
锝 | 702 | 1470 | 2850 | |||||||
钌 | 710.2 | 1620 | 2747 | |||||||
铹 | 719.7 | 1740 | 2997 | |||||||
钯 | 804.4 | 1870 | 3177 | |||||||
银 | 731.0 | 2070 | 3361 | |||||||
镉 | 867.8 | 1631.4 | 3616 | |||||||
铟 | 558.3 | 1820.7 | 2704 | 5210 | ||||||
锡 | 708.6 | 1411.8 | 2943.0 | 3930.3 | 7456 | |||||
锑 | 834 | 1594.9 | 2440 | 4260 | 5400 | 10400 | ||||
碲 | 869.3 | 1790 | 2698 | 3610 | 5668 | 6820 | 13200 | |||
碘 | 1008.4 | 1845.9 | 3180 | |||||||
氙 | 1170.4 | 2046.4 | 3099.4 | |||||||
铯 | 375.7 | 2234.3 | 3400 | |||||||
钡 | 502.9 | 965.2 | 3600 | |||||||
镧 | 538.1 | 1067 | 1850.3 | 4819 | 5940 | |||||
铈 | 534.4 | 1050 | 1949 | 3547 | 6325 | 7490 | ||||
镨 | 527 | 1020 | 2086 | 3761 | 5551 | |||||
钕 | 533.1 | 1040 | 2130 | 3900 | ||||||
钷 | 540 | 1050 | 2150 | 3970 | ||||||
钐 | 544.5 | 1070 | 2260 | 3990 | ||||||
铕 | 547.1 | 1085 | 2404 | 4120 | ||||||
轧 | 593.4 | 1170 | 1990 | 4250 | ||||||
铽 | 565.8 | 1110 | 2114 | 3839 | ||||||
镝 | 573.0 | 1130 | 2200 | 3990 | ||||||
钬 | 581.0 | 1140 | 2204 | 4100 | ||||||
铒 | 589.3 | 1150 | 2194 | 4120 | ||||||
铥 | 596.7 | 1160 | 2285 | 4120 | ||||||
镱 | 603.4 | 1174.8 | 2417 | 4203 | ||||||
镥 | 523.5 | 1340 | 2022.3 | 4370 | 6445 | |||||
铪 | 658.5 | 1440 | 2250 | 3216 | ||||||
钽 | 761 | 1500 | ||||||||
钨 | 770 | 1700 | ||||||||
铼 | 760 | 1260 | 2510 | 3640 | ||||||
锇 | 840 | 1600 | ||||||||
铱 | 880 | 1600 | ||||||||
铂 | 870 | 1791 | ||||||||
金 | 890.1 | 1980 | ||||||||
汞 | 1007.1 | 1810 | 3300 | |||||||
铊 | 589.4 | 1971 | 2878 | |||||||
铅 | 715.6 | 1450.5 | 3081.5 | 4083 | 6640 | |||||
铋 | 703 | 1610 | 2466 | 4370 | 5400 | 8520 | ||||
钋 | 812.1 | |||||||||
砹 | 910 |
电子亲和
第一电子亲和能
元素的一个基态气体原子得到一个电子成为一价气态负离子时所放出的能量称为该元素的电子亲和能(Y)。元素的电子亲和能表示得到一个电子形成负离子时放出的能量;若为负值,则表示要吸收能量(亲和能为负值的通常是金属,很难形成负离子)。
电子亲和能是元素氧化性的一个衡量标准,电子亲和能越大,该原子得电子的倾向越大,该原子对应元素的非金属性越强,电子亲和能的规律性并不强。
由于条件限制,电子亲和能还没有准确的测定方法,不同文献的电子亲和能大小相差较大,也未表现出周期变化规律,所以电子亲和能的应用并不广泛 。
以下给出部分主族元素元素电子亲和能大小,数据取自《化学-物质结构与性质(选修)》(2004年 )。
元素 | 氢 | 锂 | 铍 | 硼 | 碳 | 氮 | 氧 | 氟 | 钠 |
Y | 72.8 | 59.6 | -48.6 | 26.7 | 122 | -7 | 141 | 328 | 52.9 |
元素 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 钾 | 钙 | 镓 |
Y | -38.6 | 42.5 | 134 | 72 | 200 | 349 | 48.4 | -28.9 | 28.9 |
元素 | 锗 | 砷 | 硒 | 溴 | 铷 | 锶 | 铟 | 锡 | 碲 |
Y | 119 | 78.2 | 195 | 325 | 46.9 | -28.9 | 28.9 | 107 | 190 |
元素 | 碘 | 铯 | 钡 | 铊 | 铅 | 铋 | 钋 | 砹 | |
Y | 295 | 45.5 | -28.9 | 19.3 | 35.1 | 91.3 | 183 | 270 |
第二(及以上)电子亲和能
第二(及以上)电子亲和能对于任何元素均为负值,基本无意义 。
电负性
电负性是一组表示原子在分子成键时对电子吸引力的相对数值,电负性综合考虑了电离能和电子亲合能,首先由莱纳斯·卡尔·鲍林(L.C.Pauling)于1932年提出。元素电负性数值越大,原子在形成化学键时对成键电子的吸引力越强。
计算方法
电负性的计算方法有多种,每一种方法的电负性数值都不同,比较有代表性的有3种。
① 鲍林提出的标度。根据热化学数据和分子的键能,指定氟的电负性为3.98,计算其他元素的相对电负性。
②密立根从电离势和电子亲合能计算的绝对电负性。
③阿莱提出的建立在核和成键原子的电子静电作用基础上的电负性。利用电负性值时,必须是同一套数值进行比较。
电负性表
下表给出了常见元素的电负性大小,数据取自《化学-物质结构与性质(选修)》(2004年 )。
元素 | 氢 | 氦 | 锂 | 铍 | 硼 | 碳 | 氮 | 氧 | 氟 |
电负性 | 2.1 | - | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
元素 | 氖 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |