-
伊曲康唑注射液 编辑
药品名称:伊曲康唑注射液
药品类型:处方药、医保工伤用药
用途分类:唑类
本品主要成份:伊曲康唑
化学名称:(±)-顺式-4-甲氧基]苯基]-1-哌嗪]苯基]-2,4-二氢-2-(1-甲基丙基)-3H-1,2,4-三唑-3-酮
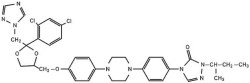
分子式:C35H38Cl2N8O4
分子量:705.64
本品为无色至微黄色的澄明液体。
伊曲康唑注射液:25ml:0.25g
氯化钠注射液:50ml:0.45g(0.9%)
用法:静脉滴注(详见后附“使用介绍”)。
用量:
–刚开始2天给予本品每日2次,以后改为每日1次。
–第1,2天治疗方法:每日2次,每次1个小时静滴200mg伊曲康唑。
–从第3天起:每日1次,每次1个小时静滴200mg伊曲康唑。静脉用药超过14天的安全性尚不明确。
或遵医嘱。
本品非常罕见严重肝毒性病例,包括肝衰竭和死亡。其中,某些病例既无既往肝病,也无严重的基础疾病。如出现肝脏疾病相关的症状和体征,应中断治疗并进行肝功能检测。使用本品的风险和利益需进行再度评估(见注意事项)。
根据360例(来自于四个药代动力学研究,一个非对照和4个活性对照研究,对照组为两性霉素B和氟康唑)使用本品治疗的患者报告得出的,有可能与药物相关的不良事件列于表1。几乎所有患者都为中性粒细胞减少或其他免疫功能低下,因发热或已证实的系统性真菌感染而接受经验性治疗,或进行药代动力学研究。使用剂量为刚开始两天静脉给与本品每日2次,每次200 mg ;以后的静脉治疗每日1次,每次200 mg。大多数的患者接受本品治疗7-14天。

下列不良事件在本品的临床试验患者中发生率小于2% :LDH升高,水肿,蛋白尿、高血糖和肝炎。在一项对血液肿瘤伴有嗜中性粒细胞减少症的患者进行的经验性治疗的开放性随机试验中,对本品与注射用两性霉素B的有效性和安全性进行了比较。
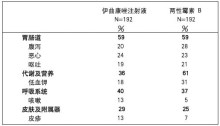
约90%使用本品的患者和约94%使用两性霉素B的患者发生至少1次不良事件。下表中为使用本品的患者
报告(发生率≥10%)的不良事件,所列的这些不良事件与研究者相关性评价结果无关。
表2.本品组发生率≥10%的不良事件
上市后经验
全球上市后伊曲康唑(所有剂型)自发报告的不良反应列于表3。不良反应按发生率分类:
很常见(≥1/10);
常见(≥1/100,且700 L),表明其组织分布广泛,在肺、肾脏、肝脏、骨骼、胃、脾和肌肉中的药物浓度比相应的血浆药物浓度高2-3倍,而角质层和皮肤中的药物浓度比相应的血浆药物浓度高4倍,脑中的药物浓度与血浆药物浓度相当。
·代谢
伊曲康唑主要在肝脏代谢成多种代谢产物。经体外试验显示,CYP3A4是参与伊曲康唑代谢的主要酶。主要代谢产物为羟基伊曲康唑,该产物在体外试验中显示了与伊曲康唑相当的抗真菌活性,其血浆浓度谷值为原形药物的2倍。
·排泄
静脉给药后,约为剂量1%以下的伊曲康唑及其活性代谢物羟基伊曲康唑经肾脏排泄。口服给予的伊曲康唑后,经粪便排泄的原形药物约为剂量的3-18%。口服给药一周内,伊曲康唑主要以无活性的代谢产物经尿(约35%)和粪便(约54%)排泄。
特殊人群
·肝损害患者
尚未进行肝损害患者使用本品的研究。伊曲康唑绝大部分在肝脏代谢。12例肝硬化患者和6例健康志愿者单剂量口服100 mg伊曲康唑胶囊,对以上2组患者的Cmax,AUC和伊曲康唑的半衰期进行对比。肝硬化患者的平均Cmax显著下降(下降47%),平均消除半衰期长于肝功能正常者(分别为37和16小时)。根据AUC值,肝硬化患者和健康志愿者伊曲康唑的总暴露量相似。尚无肝硬化患者长期使用伊曲康唑的数据。
·肾损害
经静脉给药的伊曲康唑少部分(









