-
可卡因 编辑
十三世纪,秘鲁的印加帝国将古柯树奉为神树,认为此树是神明所赐,并且在祭祀典礼中焚烧古柯树的叶子来祭奠太阳神。西班牙人征服秘鲁以后,古柯进入流通领域,被商品化。
1750年,法国的植物学家尤苏伊将第一批古柯树的样品运送到欧洲。玻利维亚拉巴斯在1781年爆发土著起义,守城的士兵在军粮不足的情况下靠着古柯叶撑了一段时间,这让欧洲的很多人了解到古柯叶的效果。有传教士因此提议用古柯叶来解决欧洲的饥荒,也有学者建议让船员多食用古柯叶,不仅能增强船员的体力,同时又能让古柯叶取代酒精,解决船员酗酒的问题。
1855年,德国化学家弗里德里希(G. Friedrich)首次从古柯叶中提取出麻药成分,并命名为Erythroxylon。1859年,奥地利化学家纽曼(AlbERT Neiman)又精制出更高纯度的物质,命名为可卡因(Cocaine)。
1880年,有“现代外科学之父”之称的霍尔斯特德(William Steward Halsted)将可卡因制成局部麻醉剂。1884年,奥地利著名心理学家西格蒙德·弗洛伊德(Sigmand Frend)首先推荐用可卡因作局部麻醉剂、性欲刺激剂、抗抑郁剂,并在其后很长时间里用于治疗幻想症,他将其称之为“富有魔力的物质”。这些结果得到学术界的广泛认可,《波士顿医学杂志》报道 “适量使用古柯不仅有益健康而且大有裨益”。《治疗学学报》报道“无论有没有鸦片瘾,人们都感到想要尝试一下古柯。情绪低落时用上点无害的药物是必不可少的。”美国神经学协会宣称“一个抑郁寡欢,沉默寡言的病人,背负最深沉的哀痛或是悲伤的人”在可卡因的作用下也会停止抽泣,高兴起来。
另外,由于可卡因可令鼻腔发干,人们认为它在治疗哮喘类疾病引起的鼻窦不适方面有特殊的用途。许多这样的药剂都制成了鼻烟状。第一家从事可卡因商业生产为德国达姆斯丹的默克公司经营,其产量由1879年的50克提升到了1885年的30kg。据统计,当时的美国市场上含可卡因药剂高达5万种以上,著名的马丁尼酒(Martini)据称每盎斯便含有11%的酒精以及6.5mg的古柯碱。1886年,随着美国部分地区颁布禁酒令,部分商人把可卡因调制为不含酒精的饮料,比如把古柯提出物与非洲可拉核液(Cola)混合。具兴奋作用,起初作为药物出售,后改制为无酒精饮料(有人认为可卡因和著名饮料可口可乐具有某种渊源,此说法无足够的证据证实,但至少1886年问世的可口可乐仍还有微量可卡因,1906年排除此配方)。
1914年,以美国国会批准哈里逊(Harrison Narcotic)法案为标志,大部分国家在法律上禁止可卡因的出售和使用。可是流行音乐人Bohemians等在20世纪60年代初开展所谓“反文化”运动,使可卡因的应用又在美国泛滥起来,并成为当时青年人的时髦。20世纪70年代末期出现了盐酸可卡因,首先在法国市场上非法出售。可服食也可溶于水作静脉注射。如与海洛因混合作静脉注射称为“快球”,因在高温中易迅速被破坏,故不能鼻吸用。
1980年,美国发明了易升华的可卡因碱克勒克。将可卡因生物碱中乙醚蒸发掉而形成结晶,极纯,为可卡因的精制品,加热时会发出特殊的响声,故定名为crack(音译为克拉克或克勒克,意即爆裂声)。市场售品名仍称可卡因游离碱或可卡因自由碱,服用时通过加热蒸发经鼻吸迅速进入肺部表面,经气体交换进入血循环,并刺激脑部,又在大循环内稀释。血值与静脉注射相等。由于使用方便,给药途径较嚼食或经口鼻摄入盐酸可卡因作用都迅速,更容易成瘾,可卡因的危害度急剧增加。
20世纪80年代,可卡因较为独特的消除疲劳功能随着功能饮料的兴起又有所被重视,但副作用仍然不低。如原产泰国的红牛自1995年12月将功能饮料的概念引进中国以来,主打“抗疲劳”功效,一直被认为是功能饮料中的领军人物,曾占到中国功能饮料70%以上的市场份额。但2004年,瑞典有3名年轻人的死亡被认为与“红牛”有关。其中2人喝了掺酒的“红牛”后死亡,另一人在繁重工作后,连续喝了数罐“红牛”,导致肾衰竭死亡。由此导致美国、英国、澳大利亚和新西兰等国家要求功能性饮料必须标注每日最大摄入量,并写明不适宜高血压、心脏病患者饮用,儿童、孕妇、哺乳期妇女及对咖啡因过敏的人禁饮。
2006年,中国国家质检总局发布公告:泰国产“红牛”饮料即日起不得向中国进口。2009年,奥地利进口的“红牛能量饮料”被台湾卫生部门验出含有微量一级毒品可卡因(每公升含0.03μg)。紧接着,香港也检测出有三款红牛饮料含有可卡因,这三款饮料为“红牛可乐”、“红牛无糖配方”及“红牛能量饮料”,每公升可卡因含量介乎0.1至0.3μg,较台湾验出的高10倍。
组成
市售的可卡因多数是从古柯叶中直接提取的,一般都不纯。主要含有苯甲酰甲基芽子碱、芽子碱(ecgonine)、苯甲酰芽子碱(benzoylecgonine,BZE)、肉桂酰可卡因、N-甲醛可卡因、6-羟基可卡因、3,4,5-三甲氧基肉桂酰可卡因和3,4,5-三甲氧基卓可卡因等。可卡因酯键不稳定,在碱性、强酸或水溶液中煮沸可迅速水解断裂酯基。主要代谢产物为苯甲酰芽子碱(大约为总量的29%-54%)、芽子碱甲醋(ecgonine methyl ester,EME,约占26%~60%),此外还有去甲可卡因(norcocaine)、乙基苯酞爱康宁(cocaethylene)、间羟基可卡因、对羟基可卡因、3-羟基-4-甲氧基可卡因、4-羟基-3-甲氧基可卡因。纯品性质
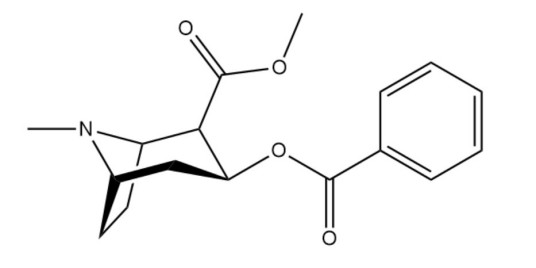
纯品可卡因的化学名称是8-甲基-3-(苯甲酰氧基)-8-氮杂双环辛烷-2-甲酸甲酯。分子式C17H21NO4,分子量303。纯品为白色结晶,无气味,味略苦而麻,不溶于水(1:600),易溶于氯仿(1:0.7)、乙醚(1:3)、乙醇(1:7)等有机溶剂,溶于丙酮、苯、乙酸乙酯、二硫化羰、石油醚等有机溶剂;在乙醇中呈现单斜片状结晶。熔点98°(90°以上即可缓慢挥发),比旋光度-16°(C=4,氯仿)。其盐酸盐为白色结晶或结晶性粉末,极易溶于水,可溶于乙醇和氯仿,但不溶于乙醚。可卡因的主要代谢产物有苯甲酰芽子碱和芽子碱甲酯,还可进一步水解生成芽子碱(又名爱冈宁)。同系列化合物
普鲁卡因(pmcaine),又名奴夫卡因(novocain),化学名为对氨基苯甲酸-3-二乙胺基乙酯,为白色细微针状结晶或结晶性粉末,无臭、味微苦而麻。熔点153~157℃。易溶于水(1:1),溶于醇(1:15),微溶于氯仿,几乎不溶于醚。2%溶液pH为5.0-6.5。对光敏感,应避光保存。
利多卡因(lidocaine),为白色结晶性粉末,有特臭。在空气中稳定,熔点65~69℃。几乎不溶于水,易溶于乙醇、氯仿和乙醚。因化学结构中的位阻效应,所以不易水解,对酸、碱均较稳定。该品盐酸盐又称又名塞罗卡因(xylocaine),为无色结晶性粉末,无臭、有苦麻味。熔点76~79℃。极易溶于水(1:1)和乙醇(1:15),可溶于氯仿(1:40),不溶于乙醚。
分类
常见的可卡因类及制剂包括:(1)古柯叶(古柯灌木的叶子,是提炼可卡因的原料,也是南美地区含微量可卡因饮品食品来源),南美地区千年历史已经证明咀嚼古柯叶不会上瘾,因为叶子中可卡因含量极低,按秘鲁库斯科的风俗折算每天摄入量不超过0.5mg;(2)可卡膏(称为basulea,一种灰白、奶白或米色的粉状物,颗粒较粗,为潮湿的团块状,有特殊气味;其实就是可卡因的粗型浸膏,含有烃的剩遗物和化学产物,有一定的成瘾危险);(3)可卡因(大部分可卡因样品为纯白到灰白色粉末,极少潮湿,有特殊气味)。国际上走私的可卡因纯度一般为80%~90%。在发达国家走私贩运过程中,一般都掺杂稀释两三倍,使其重量增加。还要掺入人工合成的麻醉剂,如利多卡因,普鲁卡因或苯唑卡因。也有的掺入碳氢化物,如甘露醇,乳糖或葡萄糖,纯度一般在30%左右。经过纯化处理即可制成快球、克勒克等成品。(4)可卡因饮料,这是早年可卡因服用的最主要方式,后来随着各国禁令的发布而逐渐消失,由于能量饮料的出现有重新抬头之势,其所含主要成分是微量的盐酸可卡因。
化学显色法,薄层层析检测法(TLC)操作简单、方便,但样品用量大,检测灵敏度和精密度均不高。仪器分析方法具有极高的灵敏度和精密度,但需要昂贵的仪器、设备和经过专门培训的技术人员,不能实现现场即时检测。
免疫检测法(mimunoassay)具有操作简便、高效、灵敏、特异、适合大规模检测等优点,但要采用这种,必须获得具有抗原活性的可卡因全抗原。通常分子量低于1000的物质不具有免疫原性,进入机体不能产生抗体,必须与载体蛋白偶联形成全抗原,方能具有免疫原性。载体蛋白中含有的活性基团主要有羧基、氨基、羟基、巯基等,依此在可卡因分子结构中引入羧基,使其与蛋白质中的氨基反应形成结合物。
高效液相色谱法,高效液相色谱的原理与气相色谱相对,可对热不稳定、不易挥发、具有大分子量的各种毒品进行分离检测,常用的检测器有紫外检测器、二极管阵列检测器、荧光检测器等。色谱/质谱联用分析法,使用GC/MS或者HPLC/MS进行毒物和药物的鉴定巳经成为国际上公认的标准方法,也是向法庭提供鉴定结果的必要条件。
生物检材
检测的生物检材种类有多种,血液和尿样是最常用的生物检材。尿样的优点在于中毒品原体和代谢物浓度较高,缺点是采集尿样要防止被水稀释、替换和掺假;而血样中毒品的成分相对稳定,萃取率高,但采集血样要避免污染。这两种方法均适用检测较近时间的服毒行为,若需检测是否有毒品滥用史,毛发则是较为理想的生物检材。但毛发中毒品的含量大大低于其它生物检材,常规分析方法难于检测,很长时间里被认为缺乏实用价值。后来随着实验技术的进步,毛发中毒品的分析成为法庭科学和临床分析的研究热点。与传统的生物检材相比,毛发样品具有采样容易、文明、不易掺假、检材稳定、易于保存、携带方便、检测期限长等优点。此外,唾液、汗液、牙齿、皮肤、指甲及其它组织器官如肝等均可用于可卡因及其代谢物的常规检测。不同的生物检材可提供不同的信息,检材的选择取决于它是否易于采集及分析目的等多种因素。生物检材收集后,要经过预处理才可进行目标组分的提取和检测。血样通过离心,取上层清液即可用于提取和检测;尿样则需通过酸解、酶解,游离出原形物或代谢产物;毛发的预处理较繁锁,需要清洗毛发表面的污染和附着物质,再选用合适的酸、碱、醇和酶水解。在建立免疫检测方法如胶体金及ELISA检测方法时,一般使用的蛋白载体蛋白有BSA,卵清白蛋白(OVA)与人血清蛋白(HAS)等,最常用的是BSA。原因是它的物理化学性质稳定,不易变性,且在不同的pH值和不同离子强度下都能保持较大的溶解度;具有较大量的反应基团,如氨基、羧基等,在有机溶剂状态下(吡啶、二甲基甲酰胺)可以和半抗原偶联。
滥用方式
可卡因滥用方式包括鼻吸/喷鼻,燃吸,注射几种。这些毒素进入人体后的作用程度与其进入的方式有很大关系。
可卡因不管经过何种途径进入体内,都能够很快地被吸收,区别只是时间的长短和效用的强弱。其代谢主要通过肝组织及血浆中实现,可卡因在体内己有用量的1%以原形由尿中排出,用量的25%-40%转为苯甲酰爱冈宁由尿中排出,18%-20%变成爱冈宁甲酯,2%-3%变为爱冈宁,也由尿中排出。
滥用表现
可卡因滥用造成急性中毒表现为极度激动、不安、精神异常、视物不清、四肢震颤,严重者可诱发心律紊乱、全身抽搐、呼吸衰竭而致死。吸食者往往表现出焦虑、倦怠和极度兴奋等症状,酷似妄想精神分裂症。由于可卡因对中枢神经系统有高度毒性,可刺激大脑皮层,产生视、听、触等幻觉,导致他们的触觉致幻尤为强烈,仿佛皮肤上总是有昆虫附着,以致发生自残行为,常常还有心理恐怖,总怀疑被人监视、跟踪。
对于长期小剂量滥用所致的慢性中毒,一般仅影响个体的进食与睡眠,产生易激惹、注意力涣散等轻微异常,主要是心理依赖性反应,生理依赖很轻。而无论急性或慢性中毒都可能导致严重的神经、精神损伤,并出现神经系统并发症,包括缺血性中风、蛛网膜下腔出血和脑出血、头痛、晕厥、癫痫发作和死亡。
急救
主要是去除毒物,尤其是用药后不久。如果是吸入,则应将药物从鼻孔移开,在使用活性炭后给予洗胃,如果肝肾功能正常,给予酸性利尿剂(氯化铵),但是有导致肾功能衰竭的危险。另外,需要有效地控制兴奋,可以减少患者的其他合并症状,如高血压、心动过速。可用冰搽全身或凉的毛毯盖身,并给予苯二氮类药物以镇定。惊厥的患者应缓慢给予5-10mg地西泮,每5min重复给予,至到总量达到30mg,但抗精神病药物可能会使高热严重,延长惊厥持续时间,最好仅用于治疗仅有精神症状者。
急性可卡因中毒的主要致死因素是呼吸中枢的高度抑制而致的呼吸衰竭。盐酸纳洛酮对麻醉镇痛剂引起的呼吸抑制有特异的拮抗作用。采用30min给药1次的方法,使纳洛酮在血浆中维持一个高浓度的水平,患者的神志、呼吸等尽快得到恢复。同时,尽早、足量的使用特异性拮抗剂纳洛酮,维持患者的血压、呼吸等生命体征。
药物成瘾(drug dependence)也称药瘾(drug addiCTion),是药物与机体相互作用所产生的一种特殊的心理状态,也包括生理状态。研究发现,躯体依赖和精神依赖同样都有其生理学基础。在使用可卡因等药物后,相应脑区的结构和功能都会发生变化。因此,一定程度上可以认为药物依赖是一种慢性复发性脑部疾病。美国国家吸毒研究所通过对可卡因成瘾的实验鼠大脑进行研究后也发现,实验鼠大脑前额叶皮质的某一区域神经元活动明显偏弱。此前已经发现人脑中的相应区域与行为控制能力有关,该区域受损或有缺陷者更容易对可卡因上瘾,戒除毒瘾也更困难。实验中,研究人员用光遗传学技术对成瘾实验鼠中脑部的这一区域进行刺激,发现这些实验鼠寻求可卡因的行为有所减少。相反,如果抑制该区域神经元的活动,实验鼠则表现出毒瘾增强的迹象。
多巴胺机制
可卡因等成瘾药物的特点在于对于神经系统既有奖赏效应又有强化效应。神经系统的奖赏是一种大脑视之为内在的、有时也是必须获得的正性刺激,而强化可认为是促使相关行为重复发生的刺激。正性强化的神经基础是众多相互联系的前脑结构,通常称之为脑的奖赏通路(reward pathway)。 奖赏通路包括伏核(nucleus accumbens,NAc),基底前脑(basal forebrain)以及内侧前额皮质(medial prefrontal cortex)等,这些结构接受中脑腹侧被盖区(ventral tegmentalarea,VTA)的多巴胺(DA)能传入神经纤维。激活中脑边缘系统多巴胺系统是可卡因成瘾性的神经生物学基础。实验表明,在可卡因的作用下,VTA中多巴胺神经元的放电活动增强,从而导致NAc及其他一些神经核的多巴胺释放增强。
可卡因对中枢神经系统的损伤与中脑边缘系统多巴胺(dopamine, DA)通路有关。这个通路源于中脑腹侧被盖区投射至腹侧纹状体的伏隔核和边缘系统的一部分,如中隔、杏仁复合体及梨状皮质。而多巴胺转运体(Dopamine transporter,DAT)是位于多巴胺神经元突触前膜的一种膜蛋白,其主要功能是重摄取突触间隙的DA,可卡因通过抑制突触前膜上的DAT,限制DA与其受体的作用时间、程度、范围。进而实现对精神和情绪活动的调控作用,即可卡因成瘾的强化效应。
在正常生理状态下, DA和Na+与突触前膜DAT上相应的位点结合,接着Cl-结合到自己的位点上,最后DAT把DA由突触间隙转运到胞内储存起来。可卡因和Na+在DAT上的结合位点相同,当可卡因存在时,它与Na+竞争性结合同一位点,使得DAT无法与DA正常结合,导致DA在突触间隙累积,使神经纤维持续性兴奋,从而让使用者产生快感。
通过对DAT缺失小鼠的研究发现,可卡因无法对不表达DAT的小鼠产生成瘾作用,表明DAT在可卡因的成瘾中发挥重要作用。还有研究认为5-羟色胺(5-HT)转运体、去甲肾上腺素转运体,伏隔核处谷氨酸转运的神经性适应、胆碱能神经元所支配的尾核、海马、腹侧被盖等脑区中乙酰胆碱更新率的改变,以及某些酶活性的改变,如激酶、磷酸酶、磷脂酶A2 及PCCT(磷脂酰胆碱合成的限速酶)等在可卡因成瘾中也有一定作用。用5-HT/DA 拮抗剂氯氮平和 5-HT受体拮抗剂均可减弱可卡因的自身给药和可卡因诱导的动物精神运动性刺激行为以及可卡因奖赏效应。但DAT在其中占主导地位。
表观遗传学机制
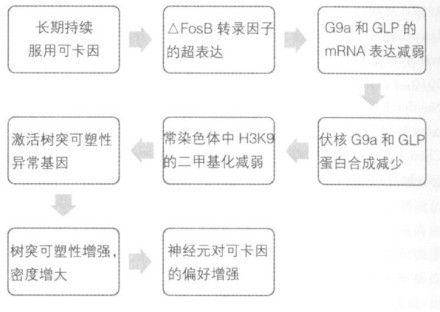
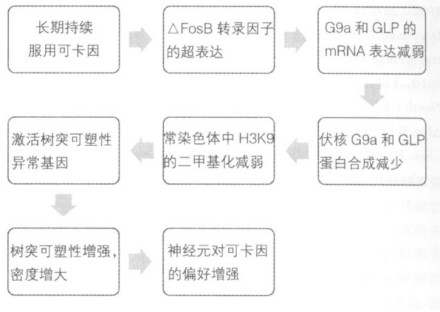
研究发现,可卡因影响某些与NAc中基因表达有关的系统,比如伏核(nucleus accumbens, NAc)是脑中奖赏回路中的一个关键性中心,已知可卡因成瘾会造成该环路中基因表达的持久性变化,而这些变化可能是可卡因成瘾的某些行为效应的基础。已知反复的可卡因作用导致啮齿类动物NAc内基因表达和神经元形态的持久变化,可卡因直接诱导NAc染色质酶的修饰,导致组蛋白乙酰化作用和磷酸化作用的改变。而在NAc中,基因特异性启动子经可卡因的反复作用后,抑制H3K9(Histone H3 lysine 9)和H3K27(Histone H3 lysine 27)甲基化。在小鼠,通过分析控制H3K9或H3K27甲基化的赖氨酸甲基转移酶(KMTs)和脱甲基酶(KDMs),发现仅有两个酶G9a和G9a相似蛋白(GLP)在反复的可卡因作用24 h后表达下调。由于G9a和GLP显著催化H3K9的二甲基化,所以G9a和GLP的表达下调与观察到的常染色质二甲基化的H3K9整体水平减少是相符的,但异染色质H3K27甲基化作用的整体水平仍不变。研究发现,G9a的超表达可以阻断反复的可卡因诱导的基因增强表达。而应用一个独立的Δfos B(一种早期快反应基因fos B的高稳定结合产物)超表达系统,在野生型小鼠的双侧NAc内超表达Δfos B,也减少二甲基化的H3K9和G9a的表达水平。在反复的可卡因作用下,对G9a和二甲基化的H3K9的抑制促进了对可卡因的嗜好,部分原因是通过调节神经元树突可塑性异常的基因转录活化,且NAc中G9a表达的下调还可以增加神经元树突棘的密度。
可卡因对消化系统、免疫系统、心血管系统和泌尿生殖系统都有损伤作用,比如作为毒性作用靶器官之一的肝脏。作为一种剂量依赖性肝毒素,可卡因可导致肝细胞大量坏死,表现为血清中ALT、AST、胆红素的升高,病理变化包括局部坏死、炎性浸润、脂肪变性等等。
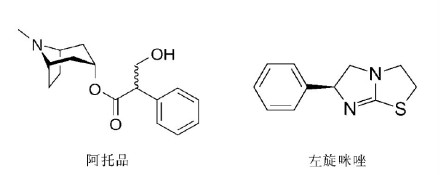
近十几年,随着各国政府对可卡因打击的增强,以及为了增加体积、降低成本,除了传统的糖类、淀粉外,制毒者开始在可卡因内掺杂多种能与之产生协同作用的掺杂剂,如左旋咪唑(leamisole)、阿托品(atropine)等。这些掺杂剂不仅会提高滥用者对可卡因的依赖程度,并且带来了很多新的问题,如掺杂左旋咪唑的可卡因会引起粒性白血球缺乏症、血管坏死,而服用掺杂阿托品的可卡因则可能出现服用抗胆碱药物的症状。神经系统
星形神经胶质细胞在神经调节与保护pH维持、生长中轴索引导控制、自稳态维持和血脑屏障维持方面起重要作用。神经胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)是星形胶质细胞的特异性标记物,用共焦显微镜观察小鼠齿状回星形神经胶质细胞对可卡因的反应发现:GFAP表达在一次可卡因注射后呈两倍增强,连续7天后仍然显著增高,但14天后未见显著不同。形态学观测显示:在星形神经胶质细胞数量、大小和形态学方面出现明显改变,这说明可卡因影响了小鼠齿状回GFAP表达,导致星形细胞增殖率和细胞形态学发生明显改变。锥体细胞是海马结构中的主细胞,其结构的紊乱和发育不良将导致海马功能异常。动物实验证明:母代妊娠中晚期接触可卡因(10mg·kg-1,9天),正常分娩后发现子鼠海马锥体细胞发育延迟、结构紊乱,未迁移到正常位置;而海马内神经胶质细胞也比对照组数量明显减少。用可卡因处理孕兔后能使新生小兔脑组织中5-HTR活性降低,说明可卡因通过降低5-HTR活性间接阻止5-HT重吸收导致细胞外5-HT浓度升高;而5-HT并不直接参与DA神经元的损伤,其对DA释放具有调节作用,5-HT浓度增高也导致DA浓度升高,然而DA再摄取被抑制,所以可卡因也可使DA神经元受损。进一步研究表明,星形胶质细胞不仅是神经元的支架细胞,而且是脑发育过程中必不可少的营养组织。因此,可卡因导致的神经胶质细胞数目减少可能是导致锥体细胞异常的原因之一。
对可卡因滥用者核磁共振检查显示:大脑腹侧正中前眶部、前扣带回、前腹侧脑岛、颞上皮质中的灰质浓度减少。功能性神经成像显示:慢性可卡因使用者额叶出现区域性脑血流不足和葡萄糖代谢水平低下。额面白质完整性检测显示:额面白质在大脑前后联合(anteriorcommissure posteriorcommis-sure,AC-PC)水平上呈分级各向异性显著下降,AC-PC水平下方5mm处也有降低趋势。可卡因吸食者的上述大脑病理性改变,导致他们与正常人在决断、行为控制、对环境刺激作出的情感反应方面出现差异。因此,可以把这些改变作为毒理学的特征性观察指标。
可卡因可以增加脑血管意外的发生率。一般认为可卡因引起的中风发病率为0.02%~4.3%,通常在应用后6小时内发生,与服用者已有的中风危险因素有关;与服用的方式无关,但静脉注射更容易引起出血性中风。引起出血性或缺血性中风的机理主要由于中枢和周围交感神经兴奋有关;另外可卡因对单胺类受体重吸收的抑制可引起血压升高,心动过速,血管痉挛,其局麻作用可以干扰细胞内的电解质引起心律失常。在应用可卡因后猛烈的血压升高是造成脑出血的重要原因;而脑缺血和梗塞往往是继发于心脏功能障碍如房颤、心律失常等。
可卡因可引起的癫痫发作。一般认为可卡因引起的癫痫发作年龄较轻(18~25岁之间),无性别差异,80%为全身性大发作,40%的人首次服用后发作,绝大部分人都合并其它药物的应用,几乎均在服用后的90min内发生。对脑影像学的检查可以发现部分人有脑器质性病变的基础。虽说可卡因引起的癫痫发作不多见,但引起的与可卡因有关的死亡率却很高。一份有关36例可卡因引起的尸解报告中有13例(36%)是由于癫痫发作引起呼吸道堵塞而死亡的。引起癫痫发生的机制尚不清楚,推测由于可卡因抑制了中枢神经轴突间隙的多巴胺和去甲肾上腺素能神经递质的重吸收,以及其本身具有的似交感神经样作用,使中枢神经元膜去极化不稳定而引起的。这种效果被称为“点燃”作用。“点燃”通常是指作用不足以引起惊厥的反复、短暂的电刺激作用于易感脑区,特别是边缘系统,导致自发性癫痫形成,包括EEG异常和进行性发展的惊厥表现。这个机制也可用来描述反复使用同一剂量的可卡因对各种行为和电生理学表现的增敏作用。
角膜
长期应用可卡因对角膜组织有明显的毒性作用。在临床上已经发现手术中应用4%可卡因溶液时间过长,出现受体角膜长时间的水肿。另外,长期使用可卡因等表面麻醉剂可以引起角膜上皮的永久性缺损,角膜组织水肿及角膜内皮的 Na+- K+- ATPase 损害。
肝脏
可卡因的氧化作用是其肝毒性产生的重要机制。可卡因在肝细胞经酶催化下可生成毒性大的中间产物并引起氧化应激,其造成肝毒性的原因推测有两种可能:一,去甲可卡因(norcocaine)拥有自由电子,从而引发自由基产生,造成氧化损伤;二,N-羟基去甲可卡因(N-dryoxyl norcocaine)和去甲可卡因硝基氧(norcocaine nitroxide)之间的相互转化造成了大量的GSH(还原型谷胱甘肽)和NADPH的消耗,最终造成了肝细胞损伤。实验也表明,氧化损伤是可卡因对小鼠肝脏的重要机制,主要表现为GSH/GSSG(GSSG)比值的降低和MDA(丙二醛)含量的升高。GSH作为组织中重要的非蛋白质巯基化合物,是一种强有力的自由基清除剂,当机体受到外源化合物攻击时,GSH能够发挥其抗氧化功能,保持细胞和膜结构的稳定性。GSH/GSSG的降低则反映出GSH的耗竭,细胞的抗氧化能力大大降低,易受到毒物造成的损伤。MDA是脂质过氧化的终产物,其含量可以反映脂质过氧化程度和细胞损伤的程度,MDA含量的升高提示脂质过氧化加重,提示氧化损伤的严重程度。在某些实验中,可卡因组小鼠GSH/GSSG的比值明显下降,且MDA的含量明显升高,说明氧化损伤是可卡因造成肝损伤的重要机制。
心脏及心血管
长期滥用可卡因所致最常见的死原因为心血管系统毒性。可卡因滥用的心血管毒性包括心肌缺血、心肌病、充血性心力衰竭、心律失常、乳头肌断裂、主动脉夹层、动脉瘤破裂、猝死、心内膜炎、脑梗死等。研究发现经鼻腔摄入常规可卡因鼻腔麻醉剂量的1 /2 或 2 /3 就可使冠脉直径缩小,冠脉血流量明显减少,收缩压和舒张压分别升高至少20mmHg和10mmHg,心率增加30次/min,对多数人来说不会诱发心肌缺血。但滥用可卡因可增加心肌氧耗,导致冠状动脉扩张,冠状动脉灌注压下降13%~68%,随后可产生持续的血管收缩,使心外膜冠状动脉直径减少5%~20%。另外,可卡因能抑制一氧化氮的生成,从而增加缩血管效应。吸入可卡因后数小时可发生延迟的或反复的冠状动脉收缩,这与可卡因的代谢产物去甲可卡因的作用有关。此外,有证据表明可卡因能够增加血黏度,含血小板的小颗粒凝聚物(使用可卡因后40~80 min达高峰)的增加,促进血栓形成。
长期滥用可卡因可导致动脉粥样硬化迅速进展。有研究证实,给兔注射可卡因,其主动脉壁的蛋白质合成速率增加,类似早期动脉硬化的过程。对145例可卡因相关死亡者的尸检发现,有46名死者有不同程度的动脉硬化。可卡因加速冠状动脉硬化的机制尚不清楚。推测与可卡因引起动脉内皮细胞及平滑肌细胞的损伤有关。可卡因可导致内皮细胞屏障结构的损害,使得低密度脂蛋白的渗出增加,并且随着内皮细胞的损伤或功能障碍的加重,血液中白细胞向血管壁趋化的黏附程度增高,同时激活血小板活性,刺激血管平滑肌细胞的增生和游走,这些平滑肌细胞的表型发生转变,由收缩型转变为合成型,不仅可以结合摄取LDL、VLDL而成为肌源性泡沫细胞,而且能合成大量胶原蛋白、弹性蛋白和蛋白多糖等细胞外基质,促进硬化斑块的形成。冠状动脉平滑肌细胞对可卡因的反应是快速凋亡,损伤程度与浓度有关。
可卡因引起的冠脉痉挛主要由α-肾上腺素能刺激介导,还有部分学者认为冠状动脉痉挛与血管内皮功能障碍有关。长期应用可卡因改变了内皮细胞的完整性,内皮细胞功能受损,减少了内皮源舒张因子(EDRF)和前列环素的产生,使阻止血小板聚集作用丧失并使内皮的扩血管能力降低,同时,可卡因可直接增强血小板的聚集,并使5-羟色胺增多,引起血管强烈收缩,继而导致闭塞性冠状动脉痉挛。
研究和尸检均发现,慢性可卡因中毒可使心脏扩大,胶原纤维数量增加。心肌中心房利钠素、β肌球蛋白、α肌动蛋白表达增加。可卡因导致心肌肥大的机制尚不清楚,可能与可卡因对心肌细胞的直接氧化作用有关。可卡因阻断交感神经末梢的突触前膜对去甲肾上腺素和多巴胺的再摄取,从而引起可以和突触受体结合的循环单胺氧化酶浓度升高,使内源性去甲肾上腺素的作用得到增强。可卡因并且可直接引起脑释放多巴胺,通过中枢神经系统引起肾上腺髓质释放去甲肾上腺素和肾上腺素。肥大的心肌中血流不足,不仅因为有微血管病的原因,还由于新生血管的生成速度慢,不能和心肌的肥大相适应。另外,肥大的心肌利用氧的有效性比正常心脏要低。可卡因滥用者中心肌肥大的存在意味着心肌相对缺血,缺血破坏了心脏的正常复极化过程,导致兴奋折返的异常,这种异常是致命性心律失常的主要原因。
长期注射可卡因者,还会引起其它冠状动脉疾病如自发性冠状动脉夹层(spontaneous coronary arterydissECTion, SCAD)。这是一种比较罕见的心血管疾病,能够引起急性心肌梗死(AMI)或心性猝死,已知的SCAD患者不过几百例。这种病在可卡因滥用者身上出现原因尚不清楚,可能是因为吸食可卡因可致血浆肾上腺素和去甲肾上腺素水平增高,从而使血压急速升高,可卡因引起的动脉压力升高和血管收缩使冠状动脉内皮承受的剪切力增大,可能导致冠状动脉夹层和内膜撕裂。该夹层可阻断流向重要脏器的血流,甚至可造成主动脉破裂。另一种可能机制是长期滥用可卡因促使动脉粥样硬化发展,并加速血管壁的退形性变化或伴结缔组织异常,这会使血管壁变得脆弱,容易发生内膜破裂和动脉夹层。
可卡因的心血管毒性需要很长的时间才能出现。如果没有遗传性离子通道疾病或者本身没有严重的心脏病, 可卡因相关的死亡通常不会在第一、二次使用就发生。
与AIDS关系
静脉注射可卡因也是AIDS感染的重要途径之一。有人发现可卡因能增强人类周围血液中的单核细胞对HIV-1的复制或者降低免疫功能,造成机会性感染。具体机理尚不清楚。
生殖系统
动物实验证实,在可卡因下暴露28天后,大鼠体重、睾丸、附睾和阴茎重量减小;血清T(大鼠睾酮)水平降低,E2(雌二醇)升高在3周龄时就可发生,6周龄时则更为明显,提示可卡因可损害各个年龄段大鼠生殖器官的生长和性腺功能,其中尤其青春发育期明显。而对于人体,实验也证明睾丸对可卡因有高度亲和力,皮下注射放射性可卡因后鼠睾丸浓度超过肌肉、肝、心和血清,仅脑组织药物浓度超过睾丸浓度。在慢性可卡因使用者中发生精子数目不正常、精子记数低、运动能力低的为多数。体外研究显示,浓度高于670μg/L已经影响精子的运动或生存能力,高浓度更可减少精子运动以及减少子宫颈粘液穿透力。
妊娠期女性使用可卡因后,除了对孕妇本身的损伤外,还能增加流产、早产、胎盘早剥、胎儿宫内发育迟缓的发生率,因为可卡因除了在母体代谢外,一部分通过胎盘屏障转运到胎儿的血循环中,尽管胎盘屏障有快速清除可卡因的功能,但连续使用可卡因后,可卡因及其代谢产物仍然可进入胎儿血中。一般认为认为妊娠中后期使用可卡因,会使胎儿宫内发育迟缓,出生体重下降,身长及头围显著下降。而胎盘在可卡因的刺激下,其本身合成蛋白质的能力下降,造成肽类激素的分泌不足,如生长激素等,导致胎儿宫内发育不良,以至于出生体重下降。另外,可卡因提高了母体和胎儿的血循环中的去甲肾上腺素的浓度,引起血管收缩,降低了子宫和胎盘的血流量,导致胎儿缺血性变化,引起发育迟缓,同时使得母体经胎盘运送到胎儿的营养物质数量减少同样也引起胎儿出生体重下降。宫内接触可卡因的婴儿体重、身长及头围比正常婴儿明显减小。生前暴露于可卡因的后代出现运动功能异常、学习和记忆能力下降、注意力不集中、条件适应能力差等神经行为异常症状。另外,生前接触可卡因还可以损伤后代中枢神经系统,使后代出现程度不同的认知、判断、思维、语言和运动障碍。
替代品
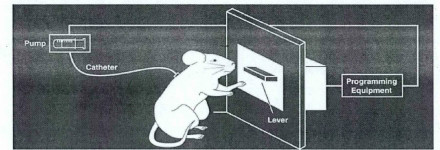
替代品的根本在于奖赏效应,而成瘾性药物的奖赏效应是导致药物成瘾的直接原因,评价药物奖赏效应的常用手段主要有条件性位置偏爱(conditioned place preference,CPP)实验和自身给药实验。已知的可卡因成瘾的治疗手段均不能起到根本性的作用,而且多处于实验室阶段,较为突出的有可卡因催化抗体和可卡因疫苗。
催化抗体
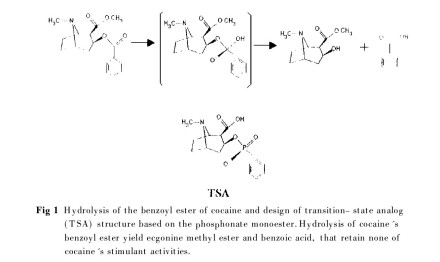
催化抗体(catalytic antibody)又称抗体酶(abzyme),是赋予抗体产生催化活性的一种人工模拟酶。可卡因催化抗体由美国研制,是用磷酸酯(可卡因过渡态类似物)通过免疫诱导作用产生的一种催化性单克隆抗体,可以催化可卡因降解脱去苯甲基,变成无成瘾性的代谢产物,并重复参与催化可卡因降解为非刺激活性产物的过程,阻断可卡因进入脑部与其受体结合。可卡因催化抗体注射后可以在体内保持几周或更长的时间,如此周期可以保证在一个月内阻断可卡因直接进入脑部。该单克隆抗体将可卡因水解之后又呈游离状态而重新获得催化作用。动物实验中,给大鼠静脉滴注致死剂量的可卡因后,五分之四的实验鼠仍然存活,48h后所有存活大鼠都又恢复到治疗前的应答水平。用一种与可卡因结构上不相似的刺激药安非他酮及一种非药物乳型增强剂测试结果显示,这种抗体对可卡因药瘾的抑制具有药理学和行为上的特异性。但催化抗体只能对小剂量成瘾有效,对抗大剂量多次的可卡因药瘾且作用不持久,预期只有研制多克隆催化性抗体或人体化的单克隆催化性抗体才有可能克服这些缺点。
催化抗体中较有代表性的是丁酰胆碱酯酶,有些资料甚至将其单列为一种可卡因替代品。丁酰胆碱酯酶可将可卡因水解成苯甲酸和芽子碱甲酰,但在人体内的这一过程速率很慢,研究人员调整了该酶的近活性区域的氨基酸,从而使这一反应的速率提高了2500倍,体外实验已证明其可以减短可卡因的半衰期。
疫苗
可卡因疫苗是由少量的以化学方式黏附在失去活性的蛋白上的药物构成的,是高蛋白(多数是毒素)衍生物,它通过刺激免疫系统产生抗体。抗可卡因抗体会锁定血流中的可卡因分子,形成药物抗体联合体,降低可卡因进入脑部的数量和速率,从而减少可卡因对大脑的刺激脑。如果接种疫苗的人产生足够的抗体,捕获和控制大部分在血液循环中的可卡因分子,可卡因将不会产生欣快或其他强化使用药物和成瘾的精神效应。
疫苗法对抗可卡因原来并不成功,一个问题在于可卡因的分子非常小,一般情况下不会激发免疫系统做出反应,但在1992年,Bagasra等使用一种血蓝蛋白(keyhole limpet hemocyanin,KLH)作为载体,在大鼠中诱发了抗可卡因抗体,而且循环抗体的水平与镇痛效应呈反比。虽然其循环抗体的滴度较低,仍难于对抗大剂量和反复摄入的可卡因。用这一思路制备的可卡因疫苗相当于在该衍生物上“勾画出一个较大的靶心”。
从1997年开始,Immulogic制药公司用人工合成的去甲可卡因衍生物与牛血清白蛋白的缀合物疫苗给小鼠免疫,该抗体与可卡因、去甲可卡因以浓度相关方式结合,而可卡因的无活性产物及结构上与可卡因不相似的局麻药普鲁卡因、利多卡因均不与其结合。用它做主动免疫后的滴度超过人体反复摄入可卡因的动脉血浆峰浓度。该抗体使静注可卡因后的分布发生显著改变(血浆中增多而脑与心脏中减少),从而有利于其治疗使用。当可卡因被代谢并从人体清除后,该抗体仍能有结合可卡因的能力。
以重组霍乱毒素B(rCTB)替代牛血清的新型疫苗给大鼠免疫后产生的MO240抗可卡因单克隆抗体能减轻其药瘾,使该鼠的寻药(drug-seeking)行为保持在低水平而从不恢复到免疫前水平。输注大剂量(10倍剂量)可卡因时也未消除此单克隆抗体对抗可卡因的保护作用。该抗体只是行为特异地对抗可卡因的药瘾,而不影响鼠的寻食行为或摄食量。
可卡因疫苗的效果仍有待观察,一般认为,只有当有此药瘾的本人具有强烈的成瘾要求时才能收到最大的疗效。否则被治疗者仍会对其他毒品产生药瘾,而抗可卡因抗体仍不能识别与可卡因在结构上相似的毒品。很多可卡因药瘾者同时也酗酒,而可卡因与乙醇在肝中形成的柯卡乙碱比前两者更具有毒性。可卡因和柯卡乙碱与抗可卡因抗体具有相同的结合能力,因而对这种人用此抗体治疗可能更有意义。这种免疫药物疗法在用药过度的病人的急救中也可能起作用。
拮抗剂
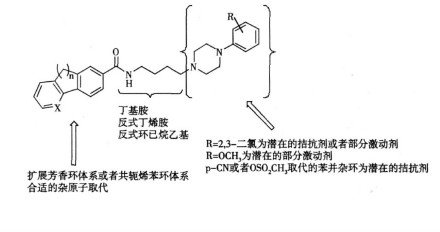
这种药物本身没有成瘾性,不影响可卡因本身激发的自身给药行为,但可降低继发程序中可卡因相关性暗示诱导的大鼠摄药行为,说明该药可以在本身依赖性潜力极小的情况下用于降低环境性复吸。减轻可卡因引起的小鼠大脑刺激奖赏(BSR)通路的左移现象,不过后来有实验表明在体内降低小鼠的可卡因渴求行为主要是拮抗D3受体的功能,而不是部分激动剂。有人将其解释为实验条件和环境不同造成的结论分歧,但事实上,重要的是部分激动剂与拮抗剂的功能其实一直没有被很好的区分过。1, 2, 4-三唑-3-硫丙基-四氢苯并氮杂类化合物就是对D3R具有高度选择性和亲和力的拮抗剂,其中化合物1在动物实验中能够阻断小鼠由尼古丁和可卡因导致的CPP的表达,阻止尼古丁引起的渴求行为的复发,减轻酒精的自我口服给药行为,增加小鼠中枢脑前额叶皮质细胞外的乙酰胆碱水平,没有造成运动功能障碍的副作用。其他潜在的治疗方式
可卡因成瘾治疗的其他方式也受到了较大的关注,如烷基类伊菠因作为兴奋剂滥用和乙醇、尼古丁成瘾的治疗正在研究之中,与可卡因相似,伊菠因表现出对中枢神经系统的广泛效应,包括对NMDA受体、DAT、5-HT的抑制作用,其抗成瘾特性来自它的复杂药理作用。另外,许多化合物间接或通过几乎未知的机理作用于可卡因途径,如金刚胺通过一种未知机理增加DA传递,并可减少可卡因成瘾。
器官治疗
心脏及心血管治疗
治疗可卡因滥用诱发的心肌缺血,可给予吸氧、阿司匹林、硝酸酯类,及时静脉注射苯二氮类以降低心率、血压并缓解胸痛。另外肝素可预防血栓形成。可卡因引起的冠脉收缩是由α-肾上腺受体介导,可用α-受体阻滞剂拮抗。拉贝洛尔兼有α、B受体阻滞作用,可用于与可卡因有关的胸痛的治疗。与单独应用可卡因比较,鼻腔内应用可卡因(2mg/kg体重)后静脉注射拉贝洛尔(0.25mg/kg体重),病人心率无变化,平均动脉压下降,冠脉管径无变化,表明拉贝洛尔可纠正可卡因引起的血压升高,但不能消除可卡因引起的血管收缩。
硝酸甘油可使正常或病变的冠脉血管扩张,消除运动、吸烟以及应用可卡因等通过α受体介导的血管收缩。舌下含服硝酸甘油0.4-0.8mg,即可消除可卡因引起的正常或病变血管收缩,同时使平均动脉压下降10%-15%,从而改善心肌供血,减少心肌氧耗。
如硝酸酯类效果不佳,钙拮抗药可作为二线用药。治疗可卡因滥用引起的ST段抬高的心肌梗死,应选择冠状动脉介入而非溶栓治疗。因为多项研究发现患者溶栓后会出现严重并发症。而可卡因相关心肌梗死往往是血管痉挛而非血栓形成所致。对于没有条件行冠状动脉介入手术者,必须严格掌握溶栓治疗的适应证和禁忌证。
滥用可卡因诱发的心力衰竭尚无特异治疗。加拿大心血管病协会推荐对所有心力衰竭患者使用ACEI和B受体阻断药,但由于许多患者继续吸食可卡因,临床上应考虑用ARB取代β受体阻断药。有报道称报道停用可卡因5~9个月后,患者的心脏大小、舒缩功能可恢复正常,LVEF明显改善。