-
电负性 编辑
首先需要说明,电负性是相对值,所以没有单位。而且电负性的计算方法有多种(即采用不同的标度),因而每一种方法的电负性数值都不同,所以利用电负性值时,必须是同一套数值进行比较。比较有代表性的电负性计算方法有3种:
① 1932年L.C.鲍林提出的标度。根据热化学数据和分子的键能,指定氟的电负性为4.0(后人改为3.98),计算其他元素的相对电负性(稀有气体未计)。
鲍林的计算方法是:
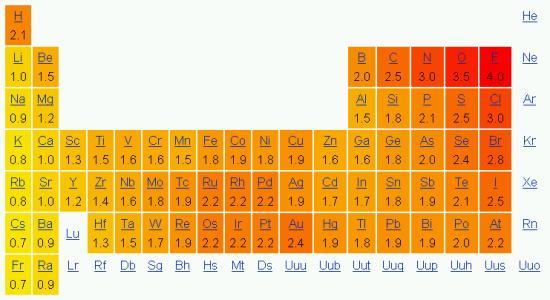 原始鲍林电负性表
原始鲍林电负性表
其中
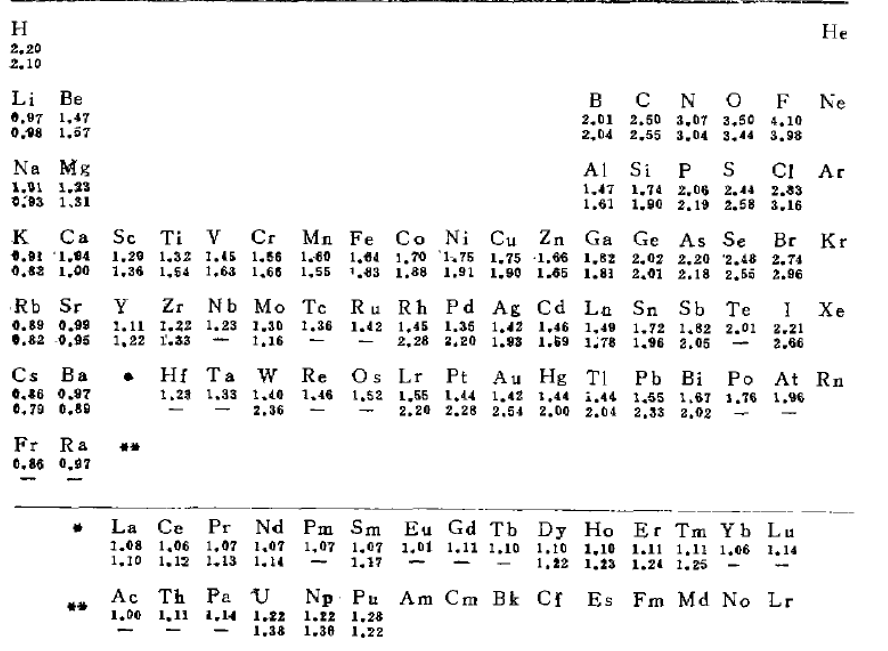 阿莱-罗周电负性表(上)和修正鲍林电负性表(下)
阿莱-罗周电负性表(上)和修正鲍林电负性表(下)
②1934年R.S.马利肯从电离势和电子亲合能计算的绝对电负性,即电离能和电子亲和能的平均值。
I为电离能,A为电子亲和能(放热为正,吸热为负)
③1956年A.L.阿莱和E.罗周提出的建立在核和成键原子的电子静电作用基础上的电负性。
即
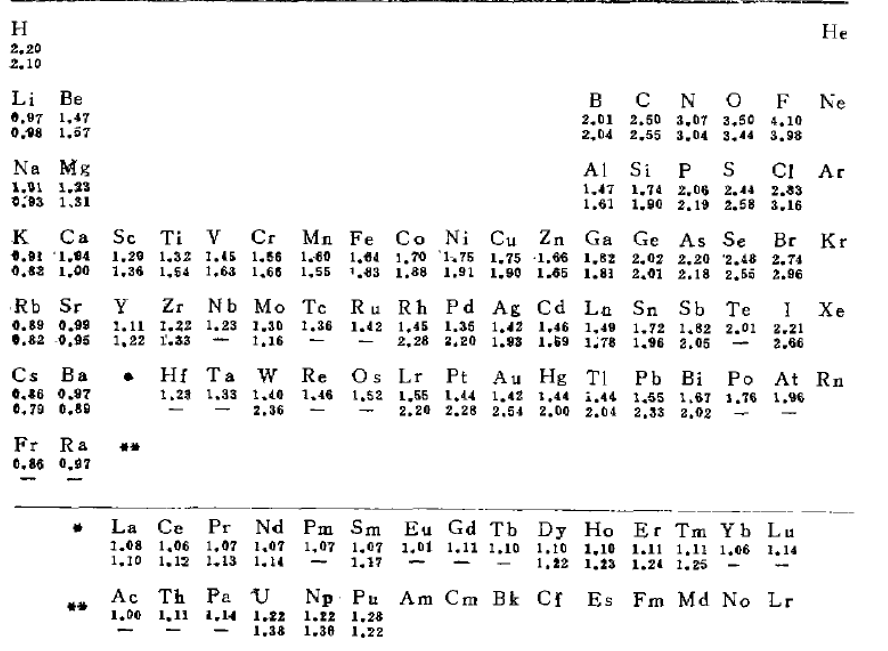
④1989年L.C.Allen根据光谱实验数据以基态自由原子价层电子的平均单位电子能量为基础获得主族元素的电负性:
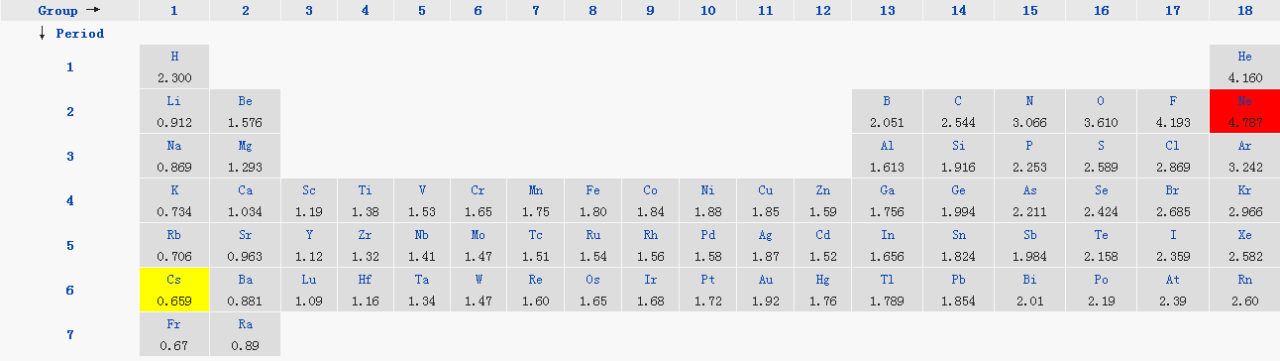 Allen光谱电负性表
Allen光谱电负性表
m和n分别为p轨道和s轨道上的电子数,Ep和Es分别为p轨道和s轨道的电子平均能量。
常见元素电负性大小(鲍林标度)
氢 2.20 锂0.98 铍 1.57 硼 2.04 碳 2.55 氮 3.04 氧 3.44 氟 3.98
钠 0.93 镁 1.31 铝 1.61 硅 1.90 磷 2.19 硫 2.58 氯 3.16
钾 0.82 钙 1.00 锰 1.55 铁 1.83 镍 1.91 铜 1.9 锌 1.65 镓 1.81 锗 2.01 砷 2.18 硒 2.48 溴 2.96
铷 0.82 锶 0.95 银 1.93 碘 2.66 钡 0.89 金 2.54 铅 2.33
一般来说,周期表从左到右,元素的电负性逐渐变大;周期表从上到下,元素的电负性逐渐变小。
电负性也可以作为判断元素的金属性和非金属性强弱的尺度。一般来说,电负性大于1.8的是非金属元素,小于1.8的是金属元素,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右,它们既有金属性又有非金属性。
1.随着原子序号的递增,元素的电负性呈现周期性变化。
2.同一周期,从左到右元素电负性递增,同一主族,自上而下元素电负性递减。对副族而言,同族元素的电负性也大体呈现这种变化趋势。因此,电负性大的元素集中在元素周期表的右上角,电负性小的元素集中在左下角。
3.电负性越大的非金属元素越活跃,电负性越小的金属元素越活泼。氟的电负性最大(4.0),是最容易参与反应的非金属;电负性最小的元素(0.79)铯是最活泼的金属。
4.过渡元素的电负性值无明显规律。
(1)判断元素的金属性和非金属性。一般认为,电负性大于1.8的是非金属元素,小于1.8的是金属元素,在1.8左右的元素既有金属性又有非金属性。
(2)判断化合物中元素化合价的正负。电负性数值小的元素在化合物吸引电子的能力弱,元素的化合价为正值;电负性大的元素在化合物中吸引电子的能力强,元素的化合价为负值。
(3)判断分子的极性和键型。电负性相同的非金属元素化合形成化合物时,形成非极性共价键,其分子都是非极性分子;通常认为,电负性差值小于1.7的两种元素的原子之间形成极性共价键,相应的化合物是共价化合物;电负性差值大于1.7的两种元素化合时,形成离子键,相应的化合物为离子化合物。
(4)元素周期表中的“对角线规则”。元素周期表中某些主族元素与右下方的主族元素电负性相近,性质相似。











