-
人工合成基因 编辑
名称: 人工合成基因
基因合成是指在体外人工合成双链DNA分子的技术,与寡核苷酸合成有所不同:寡核苷酸是单链的,所能合成的最长片段仅为100nt左右,而基因合成则为双链DNA分子合成,所能合成的长度范围50bp-12 kb。
诞生
(一)基因工程的概念
基因工程是指按照人们的愿望,进行严格的设计,通过体外DNA重组和转基因技术,赋予生物以新的遗传特性,创造出更符合人们需要的新的生物类型和生物产品。基因工程是在DNA分子水平上进行设计和施工的,又叫做DNA重组技术。
原理及技术
原理:基因重组
技术:(一)基因工程的基本工具
1.“分子手术刀”——限制性核酸内切酶(限制酶)
(2)功能:能够识别双链DNA分子的某种特定的核苷酸序列,并且使每一条链中特定部位的两个核苷酸之间的磷酸二酯键断开,因此具有专一性。
(3)结果:经限制酶切割产生的DNA片段末端通常有两种形式:黏性末端和平末端。
2.“分子缝合针”——DNA连接酶
(1)两种DNA连接酶(E.coliDNA连接酶和T4DNA连接酶)的比较:
①相同点:都缝合磷酸二酯键。
②区别:E.coliDNA连接酶来源于大肠杆菌,T4DNA连接酶来源于T4噬菌体,只能将双链DNA片段互补的黏性末端之间的磷酸二酯键连接起来;而T4DNA连接酶能缝合两种末端,但连接平末端的之间的效率较低。
(2)与DNA聚合酶作用的异同:DNA聚合酶只能将单个核苷酸加到已有的核苷酸片段的末端,形成磷酸二酯键。DNA连接酶是连接两个DNA片段的末端,形成磷酸二酯键。
3.“分子运输车”——载体
(1)载体具备的条件:①能在受体细胞中复制并稳定保存。②具有一至多个限制酶切点,供外源DNA片段插入。③具有标记基因,供重组DNA的鉴定和选择。
(2)最常用的载体是质粒,它是一种裸露的、结构简单的、独立于细菌染色体之外,并具有自我复制能力的双链环状DNA分子。
(3)其它载体: 噬菌体的衍生物、动植物病毒。
操作程序
第一步:目的基因的获取
2.原核基因采取直接分离获得,真核基因是人工合成。人工合成目的基因的常用方法有反转录法和化学合成法。
3.PCR技术扩增目的基因
(1)原理:DNA双链复制
(2)过程:第一步:加热至90~95℃DNA解链;第二步:冷却到55~60℃,引物结合到互补DNA链;第三步:加热至70~75℃,热稳定DNA聚合酶从引物起始互补链的合成。
第二步:基因表达载体的构建
1.目的:使目的基因在受体细胞中稳定存在,并且可以遗传至下一代,使目的基因能够表达和发挥作用。
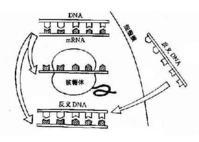
(1)启动子:是一段有特殊结构的DNA片段,位于基因的首端,是RNA聚合酶识别和结合的部位,能驱动基因转录出mRNA,最终获得所需的蛋白质。
(2)终止子:也是一段有特殊结构的DNA片段 ,位于基因的尾端。
(3)标记基因的作用:是为了鉴定受体细胞中是否含有目的基因,从而将含有目的基因的细胞筛选出来。常用的标记基因是抗生素基因。
第三步:将目的基因导入受体细胞
1.转化的概念:是目的基因进入受体细胞内,并且在受体细胞内维持稳定和表达的过程。
2.常用的转化方法:
将目的基因导入植物细胞:采用最多的方法是 农杆菌转化法,其次还有基因枪法和花粉管通道法等。
将目的基因导入动物细胞:最常用的方法是显微注射技术。此方法的受体细胞多是受精卵。
3.重组细胞导入受体细胞后,筛选含有基因表达载体受体细胞的依据是标记基因是否表达。
第四步:目的基因的检测和表达
1.首先要检测 转基因生物的染色体DNA上是否插入了目的基因,方法是采用DNA分子杂交技术。
2.其次还要检测 目的基因是否转录出了mRNA,方法是采用标记的目的基因作探针与mRNA杂交。
3.最后检测 目的基因是否翻译成蛋白质,方法是从转基因生物中提取蛋白质,用相应的抗体进行 抗原-抗体杂交。
4.有时还需进行个体生物学水平的鉴定。如转基因抗虫植物是否出现抗虫性状。
应用
1.植物基因工程:抗虫、抗病、抗逆转基因植物,利用转基因改良植物的品质。
2.动物基因工程:提高动物生长速度、改善畜产品品质、用转基因动物生产药物。
3.基因治疗:把正常的外源基因导入病人体内,使该基因表达产物发挥作用。
蛋白质工程
蛋白质工程是指以蛋白质分子的结构规律及其生物功能的关系作为基础,通过基因修饰或基因合成,对现有蛋白质进行改造,或制造一种新的蛋白质,以满足人类的生产和生活的需求。(基因工程在原则上只能生产自然界已存在的蛋白质)(1)蛋白质工程崛起的缘由:基因工程只能生产自然界已存在的蛋白质
(2)蛋白质工程的基本原理:它可以根据人的需求来设计蛋白质的结构,又称为第二代的基因工程。
基本途径:从预期的蛋白质功能出发,设计预期的蛋白质结构,推测应有的氨基酸序列,找到相对应的脱氧核苷酸序列(基因)以上是蛋白质工程特有的途径;以下按照基因工程的一般步骤进行。(注意:目的基因只能用人工合成的方法)
1974年,科恩把金黄色萄葡球菌的质粒(上面具有抗青霉素的基因)和大肠杆菌的质粒“组装”成“杂合质粒”,“送入”大肠杆菌体内,使这种大肠杆菌获得了对青霉素的抗药性,这说明,金黄色葡萄球菌质粒上的抗青霉素基因,由“杂合质粒”带到大肠杆菌体内了,更重要的是表明外来基因在大肠杆菌体内同样也发生作用(专业上称为表达)。同年,他从非洲爪蟾的DNA上“裁剪”了一段与大肠杆菌的质粒“拼接”,获得成功,拼接后的质粒带着非洲爪蟾的基因进入大肠杆菌了,大肠杆菌即产生了非洲爪蟾的核糖体核糖核酸(rRNA)。科恩又一次成为开创者。两栖动物的基因能在细菌里发挥作用,也能在细菌里不断复制的事实告诉人们,基因工程完全可以不受生物种类的限制,而按照人类的意愿去拼接基因,创造新的生物,如创造缫丝的大肠杆菌、制药的大肠杆菌等等。当科恩取得了第三次的成功后,他立即以DNA重组技术发明人的身份向美国专利局申报了世界上第一个基因工程的技术专利,成为实施基因工程的第一人。
由科恩首次取得成功的基因工程不仅打破了不同物种在亿万年中形成的天然屏障,预示着任何不同种类生物的基因都能通过基因工程技术重组到一起。科恩的专利也同样标志着人类确实可以根据自己的意愿、目的,定向地改造生物的遗传特性,甚至创造新的生命类型。科恩专利技术引起了全球轰动,在短短几年中,世界上许多国家的上百个实验室开展了基因工程的研究。
1970年,印度血统的美籍学者科兰纳首次用化学方法人工合成了有77个核苷酸对的酵母丙氨酸的结构基因。1972年,巴梯摩尔、斯派戈尔曼、列捷尔等领导的实验室各自用反向转录酶合成了家兔和人的珠蛋白基因,这是首次合成的真核生物基因。1973年,科兰纳再次得手,他合成了具有126个核苷酸对的大肠杆菌酪氨酸运转RNA(tRNA)基因。为了使合成的基因能发挥作用,科兰纳等经过三年埋头苦干,在1976年8月,终于使大肠杆菌酪氨酸运转RNA(tRNA)基因顺利地转录出酪氨酸tRNA。
1977年,美国加利福尼亚大学的博耶,用化学方法合成了人生长激素抑制因子的基因。人生长激素抑制因子是人脑、肠管、胰腺中分泌出来的一种神经激素,它能抑制甲状腺刺激激素,促胃液素、胰岛素和胰高血糖素的分泌,对肢端肥大症、急性胰腺炎和糖尿病等多种疾病都有医疗价值。之后,博耶将这个人工合成的基因与大肠杆菌质粒重组,重组DNA在质粒运载下顺利地进入大肠杆菌,这个人工合成的基因在大肠杆菌中为博耶制造出5毫克人的生长激素抑制因子。这5毫克生长激素抑制因子可以说是人造基因献给博耶的厚礼。如果用传统的办法从绵羊中提取5毫克生长激素抑制因子,那就要有50万个绵羊脑袋。
合成基因的细胞
美国科研人员培育出第一个由人工合成基因组控制的细胞,向人造生命形式迈出了关键一步。这几天来,该成果引起了国际同行的广泛关注。称赞者有之,担心者亦有之。沪上相关领域的专家同样高度关注,不过态度大多谨慎。他们认为,距离真正的人工合成生命,尚有很远的路要走。
完成这项研究的,是美国克雷格·文特尔研究所的研究人员。他们选取一种蕈状支原体,对其基因组进行解码并复制,产生人造的合成基因组。然后将其移植入另一种山羊支原体内,通过分裂和增生,山羊支原体的细胞逐渐为人造基因所控制,最终成为一种全新的生命。研究小组还计划用类似技术制造一系列新的微生物,比如可生产生物燃料的细菌、可以从空气中吸收二氧化碳和其他污染物的细菌,或是能制造出合成疫苗所需蛋白质的特殊细菌……
项目的负责人认为,此举意味着“一个新时代的到来”。也有不少外国专家给出了很高评价,例如,美国拉特格斯大学分子生物学家理查德·埃布赖特说:“这是人与自然关系的一个转折点,历史上第一次有人创造了一个完整的带有预定特性的细胞。”斯坦福大学生物医学伦理中心主任戴维·马格努斯认为,这项研究可能开启基因工程新纪元。新一期的《经济学人》杂志也用封面文章的形式对此进行报道,文章认为,“在某种程度上,这种创造生命的举动比第一颗原子弹爆炸更能证明人类掌控自然的能力。”
相比之下,国内专家对此的评价更加谨慎。沪上一位从事基因研究的专家认为,其实一直以来人为修改、合成其他生物的部分DNA已经是基因学、遗传学领域常用的实验室手段。此次研究的含金量在于人工合成了基因组,并使其发挥了作用。严格来说,这是基于现有技术的一次重大进步,但要说“划时代意义”,恐怕还谈不上。
科幻电影《黑客帝国》里,基因工程技术已经发展到可以人工造出“人类”来。类似的题材,也经常在其他科幻作品中出现。那么首个人造单细胞生物的出现,是否意味着上述情景正在变成现实,人类从此可以随心所欲创造新生命。
专家认为还没到担忧这一点的时候。因为此次试验的对象支原体是发现的最小、最简单的原核生物。它的大小介于细胞和病毒之间,内部结构很简单,唯一可见的细胞器是核糖体,这是细胞内蛋白质合成的分子机器。蛋白质是根据基因信息合成的,支原体的蛋白质数量大约有上百个,而人体细胞的蛋白质数以万计。无论是从DNA碱基对数量、蛋白质数量还是细胞结构角度,最简单的支原体和最复杂的生命形式———人,两者之间有云泥之别,人工合成支原体的成功,并不能推导出合成“人”。
对于“人造生命”的定义,业内也有不同看法。国外有专家认为,该研究并未跨越“无中生有、创造生命”的界限,只是一个带有人造基因组的生物体,而非人造生物体。沪上一位不愿意透露姓名的专家认为,人造生命应该是由人造DNA和人造蛋白质“组装”而成。以人类掌握的科学知识和技术手段,距离这一步还非常遥远。
尽管对该研究的评价高低不一,但对相关技术加强监管,却已成为国际共识。有消息称,美国总统奥巴马已在第一时间致信生物伦理问题专家,要求评估这类研究在医学、环境、安全等领域的影响;国外的激进团体则警告,当心从此打开“潘多拉魔盒”。沪上专家认为,尽管该技术不具备推广价值,但对其“不可控因素”应尽早引起重视。一旦某些非法集团掌握相关技术,制造出新的有害微生物和其他生物武器,后果不堪设想。
事实上,近年来,克隆技术、干细胞技术和基因工程等飞速发展,由此引发的伦理和道德之争从未止息。复旦大学生命科学学院细胞学教授吴超群认为,对待此类问题最重要的是“理性”,一味称赞和过度紧张皆非明智之举。其实,我国对于转基因技术“扶持+控制”的思路很值得借鉴。为了防止转基因作物因生物优势对传统作物造成挤压和排斥,我国严格划定了转基因作物的种植范围,从而保护了生物品种的多样性。
该研究引发的更深层次伦理争议在于哲学层面。当人类成为和大自然并驾齐驱的“造物主”,创造出自然世界中本身不存在的DNA、进而创造全新生命,人类究竟该如何看待自身在宇宙中的位置。如果说,合理应用尚有措施可控,那么这些关乎人类存在本质的终极命题,将在更广范围内引起讨论。