-
可待因 编辑
中文名:可待因
外文名:Codeine
别名:17-甲基-3-甲氧基-4,5α-环氧-7,8-二去氢吗啡喃-6α-醇
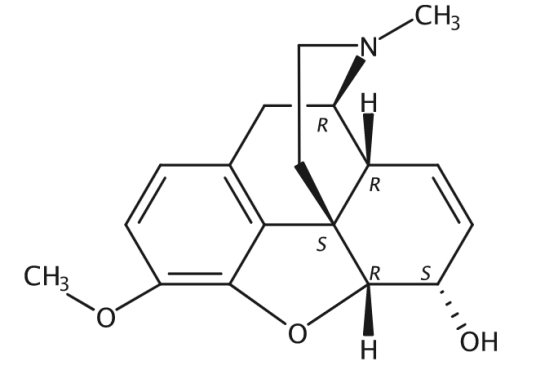
化学式:C18H21NO3
分子量:299.364
CAS登录号:76-57-3
熔点:154至156℃
沸点:250℃
密度:1.34g/cm³
外观:白色结晶性粉末
闪点:75℃
危险性符号:F;T
危险性描述:R11;R39/23/24/25
熔点:154-156℃
沸点:462℃
密度:1.34g/cm3
闪点:75℃
外观:白色结晶性粉末
计算化学数据
2.氢键供体数量:1
3.氢键受体数量:4
4.可旋转化学键数量:1
5.互变异构体数量:0
6.拓扑分子极性表面积:41.9
7.重原子数量:22
8.表面电荷:0
9.复杂度:509
10.同位素原子数量:0
11.确定原子立构中心数量::5
12.不确定原子立构中心数量:0
13.确定化学键立构中心数量:0
14.不确定化学键立构中心数量:0
15.共价键单元数量:1
能直接抑制延脑的咳嗽中枢,止咳作用迅速而强大,其作用强度约为吗啡的1/4。也有镇痛作用,约为吗啡的1/12~1/7,但强于一般解热镇痛药。其镇痛、呼吸抑制、便秘、耐受性及成瘾性等作用均较吗啡弱。口服吸收快而完全,其生物利用度为40%~70%。一次口服后,约1小时血药浓度达高峰,t1/2约为3~4小时。易于透过血脑屏障及胎盘,主要在肝脏与葡萄糖醛酸结合,约15%经脱甲基变为吗啡。其代谢产物主要经尿排泄。
①各种原因引起的剧烈干咳和刺激性咳嗽,尤适用于伴有胸痛的剧烈干咳。由于本品能抑制呼吸道腺体分泌和纤毛运动,故对有少量痰液的剧烈咳嗽,应与祛痰药并用。②可用于中等度疼痛的镇痛。③局部麻醉或全身麻醉时的辅助用药,具有镇静作用。
18岁以下青少年儿童禁用。
(1)本品与抗胆碱药合用时,可加重便秘或尿潴留的不良反应。(2)与美沙酮或其他吗啡类中枢抑制药合用时,可加重中枢性呼吸抑制作用。(3)与肌肉松弛药合用时,呼吸抑制更为显著。(4)本品抑制齐多夫定代谢,避免二者合用。(5)与甲喹酮合用,可增强本品的镇咳和镇痛作用。(6)本品可增强解热镇痛药的镇痛作用。(7)与巴比妥类药物合用,可加重中枢抑制作用。(8)与西咪替丁合用,可诱发精神错乱,定向力障碍及呼吸急促。
片剂:15mg、30mg
【鉴别】(1)取本品约0.2g,加水4mL溶解后,在不断搅拌下滴加20%氢氧化钠溶液至出现白色沉淀,用玻璃棒摩擦器壁使沉淀完全,过滤;沉淀用水洗净,在105℃干燥1小时,依法测定(附录Ⅵ C),熔点为154~158℃。(2) 取本品约0.1g,加水5mL溶解后,滴加氨试液使成碱性,不得生成沉淀。(3) 取本品约1mg,置白瓷板上,加含亚硒酸2.5mg的硫酸0.5mL,立即显绿色,渐变蓝色。(4) 本品的红外光吸收图谱应与对照的图谱(光谱集 92图)一致。(5) 本品的水溶液显磷酸盐的鉴别反应(附录Ⅲ)。
【检查】 酸度
取本品0.4g,加水10mL溶解后,依法测定(附录Ⅵ H),pH值应为4.0~5.0。溶
液的澄清度与颜色
取本品0.4g,加新沸过的冷水10mL溶解后,溶液应澄清无色;如显浑浊,与1号浊度标准液 ( 附录Ⅸ B )比较,不得更浓;如显色,与黄色2号标准比色液 (附录Ⅸ A第一法)比较,不得更深。
气化物
取本品0.10g,依法检查(附录Ⅷ A),与标准氯化钠溶液5.0mL制成的对照液比较,不得更浓(0.05%)。
取本品0.20g,依法检査(附录Ⅷ B),如发生浑浊,与标准硫酸钾溶液2.0mL制成的对照液比较,不得更浓 (0.1%)。
取本品,精密称定,加流动相溶解并稀释制成 每1mL中含10mg的溶液作为供试品溶液;另取吗啡对照品,精密称定,用流动相溶解并稀释制成每1mL中含1mg的溶液作为对照品溶液;精密量取供试品溶液0.2mL与对照品溶液1mL,置同一100mL量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液。照髙效液相色谱法(附录V D)试验,用十八烷基硅烷键合硅胶为填充剂;以0.03mol/L醋酸钠溶液(用冰醋酸调节pH值至3.5)-甲醇(60:10)为流动相;检测波长为 230nm;理论板数按磷酸可待因峰计箅不低于2000,吗啡峰与磷酸可待因峰的分离度应符合要求。取对照溶液10μL注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%。再精密量取供试品溶液和对照溶液各10μL,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍,供试品溶液的色谱图中如有与吗啡峰保留时间一致的色谱峰,其峰面积不得大于对照溶液中吗啡峰面积(0.1% );其他单个杂质的峰面积不得大于对照溶液中磷酸可待因峰面积的2.5倍(0.5%);各杂质峰面积的和不得大于对照溶液中磷酸可待因峰面积的5倍(1.0%)。
干燥失重
取本品,在105℃干燥至恒重,减失重量应为 5.0%~7.5% (附录Ⅷ L)。
【含量测定】取本品约0.25g,精密称定,加冰醋酸10mL溶解后,加结晶紫指示液1滴,用髙氯酸滴定液(0.1mol/L)滴定至溶液显绿色,并将滴定的结果用空白试验校正。每1mL高氯酸滴定液(0.1mol/L)相当于39.74mg的C18H21NO3·H3PO4
【类别】镇痛药,镇咳药。
【贮藏】遮光,密封保存。
全文如下
为进一步保障公众用药安全,国家药品监督管理局决定对含可待因感冒药说明书【禁忌】、【儿童用药】项进行修订。现将有关事项公告如下:
一、所有含可待因感冒药药品生产企业均应当依据《药品注册管理办法》等有关规定,按照含可待因感冒药药品说明书修订要求(见附件),提出修订说明书的补充申请,于2018年11月5日前报省级药品监管部门备案。
修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。在补充申请备案后6个月内对已出厂的药品说明书及标签予以更换。
各含可待因感冒药药品生产企业应当对新增不良反应发生机制开展深入研究,采取有效措施做好使用和安全性问题的宣传培训,指导医师合理用药。
二、临床医师应当仔细阅读含可待因感冒药药品说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的效益/风险分析。
三、患者应当严格遵医嘱用药,用药前应当仔细阅读说明书。
四、请省级药品监管部门在日常监管中督促企业做好有关产品说明书修改和标签说明书更换工作。
特此公告。
附件:含可待因感冒药药品说明书修订要求
国家药品监督管理局
2018年9月4日