-
败血症 编辑
败血症,又被叫做"脓毒症"或“全身性感染”,是指由于细菌、真菌、病毒等感染引起的全身炎症反应失衡,导致的严重生命威胁的器官功能障碍。常见于肺炎、腹膜炎、胆管炎、泌尿系统感染、蜂窝织炎和脓肿等疾病。脓毒症除了与细菌感染密切相关外,具体的疾病类型和表现还可以依赖于感染的病原菌类型与患者的人群差异,例如革兰阳性菌脓毒症、革兰阴性杆菌脓毒症、厌氧菌脓毒症、真菌脓毒症及病毒性脓毒症和老年人与新生儿的脓毒症等。
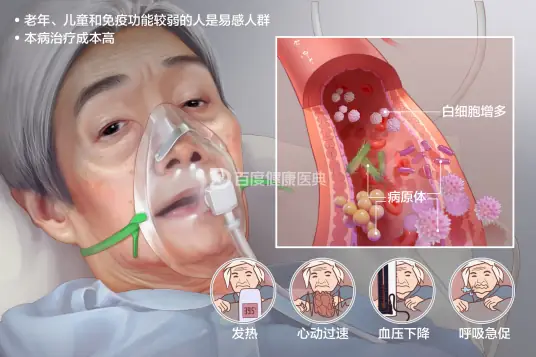
败血症患者常表现出发热、心动过速、血压下降、呼吸急促、意识改变、四肢厥冷、皮肤发绀、尿量减少等症状。更急重的病例,脓毒症基础上,患者可能会出现循环和细胞/代谢功能障碍,进一步转化为脓毒性休克。败血症并非是传染病,其产生主要与患者本身免疫功能助攻和病原菌的侵入有关,所以其防止和治疗主要集中在控制感染和改善患者的抗病能力上。
针对败血症的治疗还没有特异性的方法。当前的治疗策略主要包括控制感染、清除感染源、经验性使用抗生素、综合治疗等。在治疗的同时,必须尽快找到并去除感染源,使患者的疾病状态得到有效的改善。早期进行液体复苏以改善脏器低灌注状态,对改善脓毒症休克患者的预后十分关键。
败血症的发生率和死亡率在不同地区存在较大差异,较高的地区包括撒哈拉以南的非洲、大洋洲、南亚、东亚和东南亚。在发达和发展中的国家中,败血症的发病和死亡率都相对较高,但在发达国家中,治疗和预后效果较好。
中医病名:败血症
别名:脓毒症、全身性感染
就诊科室:感染科、急诊科、ICU
常见发病部位:全身
常见病因:毒力强的病菌与毒素不断侵入血液循环,局部与全身感染引发大量炎症介质生成与释放,激发全身性炎症反应,造成广泛的内皮炎症改变、凝血及纤溶系统、血管张力调节的改变以及心脏抑制
常见症状:发热、心动过速、血压下降、呼吸急促、意识改变、四肢厥冷、皮肤发绀、尿量减少和外周血白细胞增多、高乳酸血症
传染性:否
是否遗传:否
脓毒症可以由任何部位的感染引起,毒力强的病菌与毒素不断侵入血液循环,局部与全身感染引发大量炎症介质生成与释放,激发全身性炎症反应,造成广泛的内皮炎症改变、凝血及纤溶系统、血管张力调节的改变以及心脏抑制,导致微循环障碍及组织低灌注,引起器官功能不全称为脓毒症。
临床上常见于肺炎、腹膜炎、胆管炎、泌尿系统感染、蜂窝织炎和脓肿等。自身免疫功能的下降,细胞毒性药物使用、手术、侵入性检查和慢性疾病是常见的诱发因素。
发病原因
人体自身因素
人体自身因素主要包括如下几点:
细胞毒药物、放射治疗、广谱抗菌药、肾上腺皮质激素及免疫抑制剂的广泛应用。
物理防御屏障破坏,如进行重要器官大手术、气管插管、静脉导管、严重外伤烧伤等。
外部致病因素
外部致病因素如下:
脓毒症类型 | 致病菌/致病因素 |
|---|---|
革兰阳性细菌脓毒症 | 以金葡菌为代表,如耐甲氧西林金葡菌等感染 |
革兰阴性杆菌脓毒症 | |
厌氧菌脓毒症 | |
真菌脓毒症 | |
老年人脓毒症 | 大肠埃希菌、克雷伯杆菌等革兰阴性细菌以及厌氧菌感染为主 |
新生儿脓毒症 | |
医院感染脓毒症 | 革兰阴性耐药菌主要以大肠埃希菌、铜绿假单胞菌、克雷伯杆菌、不动杆菌等为主;革兰阳性球菌主要以耐甲氧西林金黄葡菌(MRSA)、耐药凝固酶阴性葡萄球菌(MRCNS)较为多见;真菌尤其是白色假丝酵母菌感染逐年增加。 |
诱发因素
诱发脓毒症的因素包括:
机体免疫功能缺陷或下降;
细胞毒性药物;
皮肤外伤;
黏膜屏障结构破坏;
严重外伤;
烧伤;
糖尿病;
结缔组织病;
肝硬化;
尿毒症;
慢性肺部疾病等。
最常见的症状是发热、心动过速、血压下降、呼吸急促、意识改变、四肢厥冷、皮肤发绀、尿量减少和外周血白细胞增多、高乳酸血症。
根据脓毒症3.0标准,感染+器官功能障碍(SOFA≥2分)即为脓毒症。
典型症状
常见原发病灶为脓肿、痈或毛囊炎,皮肤烧伤、开放性创伤感染、压疮以及呼吸道、泌尿道、消化道、生殖系统感染等。全身情况有发热(>38.3℃)或低体温(<36℃);心率增快(>90次/分)或>年龄正常值之上2个标准差;呼吸增快(>30次/分);血压降低(收缩压<100mmHg或较基础值下降>30%);意识改变;尿量减少;腹胀腹泻;皮肤黏膜下出血等;严重者还可出现感染性休克、昏迷、心脏骤停等。
成人败血症患者主要表现
毒血症状
患者常有寒战、高热,伴有全身不适、头痛、肌肉和关节疼痛、无力,脉搏、呼吸加快。
严重脓毒症可发生肠麻痹、感染性休克及弥散性血管内凝血、中毒性脑病、中毒性心肌炎等。
以瘀点最常见,也可表现为荨麻疹,猩红热样皮疹、脓疱疹、烫伤样皮疹、瘀斑等。
关节损害
表现为膝关节等大关节红肿、疼痛、活动受限,少数有关节腔积液或积脓。
常仅为轻度肿大,当并发中毒性肝炎或肝脓肿时,肝脏肿大显著,伴压痛,也可有黄疸。
原发病灶
常见原发病灶为脓肿、痈或毛囊炎,皮肤烧伤、开放性创伤感染、压疮以及呼吸道、泌尿道、消化道、生殖系统感染等。
迁徙性病灶
从第2周开始,可不断出现转移性脓肿,常见的有皮下脓肿、肺脓肿、骨髓炎、关节炎及心包炎等。
新生儿败血症患者常表现
全身症状
常有发热、体温不稳、反应差、喂养困难、水肿等症状
局部症状
消化系统:黄疸、腹胀、呕吐、腹泻等。
住院的患者,如果出现感染症状的同时合并意识障碍、呼吸次数≥22次/分及收缩压<100次/分或较基础血压下降30mmHg中的两项,就高度怀疑为脓毒症。
就诊科室
感染科,若不明病因且发病较急,也可由急诊科初诊后分诊,去除或明确感染原因后转入ICU进行救治。
相关检查
血液检查:患病时白细胞增多(>12×109/L)或白细胞减少(<4×109/L)或白细胞正常但不成熟细胞>10%;并发弥散性血管内凝血时血小板减少。
病原学检查
取血液、体液(如脓液、胸水、腹水、脑脊液等)或骨髓进行培养,以检出病原菌。
其他检查
血浆C反应蛋白>正常值2个标准差;
血浆降钙素原>正常值2个标准差对细菌诊断有参考意义;
鲎试验(LLT)阳性显示血清中存在内毒素,有助于革兰阴性杆菌感染的诊断。
器官功能障碍检查
氧合指数(PaO2/FiO2)<300;急性少尿(尿量<0.5ml/kg/h);肌酐增加≥44.2μmol/L;凝血功能异常(国际标准化比值>1.5或活化部分凝血活酶时间>60s);肠麻痹,如肠鸣音消失;血小板减少(<100×109/L);高胆红素血症(总胆红素>70mmol/L)。
组织灌注检查
主要检查:是否有高乳酸血症;神志及精神状态;氧分压;尿量;毛细血管再充盈时间延长或皮肤出现花斑等状况。
除此之外,新生儿还应进行血液非特异性检查(包括白细胞、中性粒细胞和血小板计数等),以及脑脊液检查。
鉴别诊断
需要与非感染性因素造成的炎症反应鉴别:例如各种结缔组织病(类风湿、皮肌炎等)、血液肿瘤病等。此外还需要与其它原因造成的休克鉴别。
低血容量性休克
由于大量失血、失液、烧伤等原因,引起血容量急剧减少,而出现循环衰竭的现象。此时静脉压降低,回心血量减少,心排血量降低,周围血管呈收缩状态。经扩容后很快纠正。
常发生在原有心脏病、心肌炎、心包填塞、严重心律失常、心力衰竭等基础上。中心静脉压升高,心指数下降,肺动脉楔压及中心静脉压升高,心电图、血液动力学异常均有助于鉴别诊断。
过敏性休克
外界抗原性物质进入机体后,与相应的抗体相互作用引起的一种强烈的全身性过敏反应。
过敏性休克为Ⅰ型超敏反应,组胺、缓激肽、5-羟色胺、血小板激活因子等大量释放,导致全身毛细血管扩张,通透性增加,血浆渗出,循环血量急剧减少。患儿多有致敏物质接触史。
神经源性休克
动脉阻力调节功能严重障碍,血管张力丧失,引起血管扩张,导致周围血管阻力降低,有效血容量减少的休克。
多见于严重创伤、剧烈疼痛(胸腔、腹腔或心包穿刺等)刺激,高位脊髓麻醉或损伤等。
非感染导致的器官功能障碍
目前尚无有效的特异性的治疗方法,治疗措施主要包括以下几点。
控制感染
祛除感染源
在脓毒症治疗的同时,即应该积极寻找引起感染的原因:如涉及到外科感染(如化脓性胆管炎、脓肿形成、肠梗阻、化脓性阑尾炎等),应及时手术干预,清除病灶或进行引流;如为医源性材料感染(如静脉导管、导尿管或植入人工器材等)应及时取出材料并作微生物培养。
获取生物学证据
尽可能在使用抗生素之前留取生物学标本,进行细菌/真菌培养,标本包括血液、痰液、尿液、伤口分泌物等标本,培养结果有助于进行针对性的使用抗生素治疗。但并非脓毒症所有的生物学标本培养都会有阳性结果。
使用抗生素
由于早期不可能很快获得细菌培养的结果,因此脓毒症早期应尽快给予经验性抗生素治疗,所谓经验性抗生素治疗应是根据该地区细菌流行病学特点和疾病的特点,针对性的选择一种或多种抗生素,所选抗生素应对所有可能的病原微生物(细菌/真菌)均有效,并能到达足够的治疗浓度,同时根据病情进行疗效评估,既保证疗效又要防止发生细菌耐药。
一旦获得细菌培养结果,应根据药敏结果结合临床情况尽快改为靶向治疗,使用有效地窄谱抗生素。合理进行经验性抗生素治疗和靶向治疗,是避免抗生素滥用和发生抗生素耐药的重要措施。
准确了解脓毒症患者的疾病状态是治疗脓毒症休克不可缺少的部分,其中能够反映机体血流动力学和微循环灌注的指标尤为重要,因此掌握脓毒症常用的监测指标的方法及临床意义是医生的重要技能。
中心静脉压(CVP)和肺动脉嵌压(PAWP)
CVP和PAWP分别反映右心室舒张末压和左心室舒张末压,是反映前负荷的压力指标,中心静脉导管应该在严重脓毒症患者中尽早放置,肺动脉漂浮导管则根据病情考虑放置。
中心静脉血氧饱和度(ScvO2)和混合静脉氧饱和度(SvO2)
在脓毒症和脓毒症休克的早期,即使此时机体的血压、心率、尿量和CVP处于正常范围内,此时全身组织灌注就已经发生灌注不足,而ScvO2和SvO2能较早的反映组织这种灌注状态。研究表明在脓毒症和脓毒症休克中,SvO2<70%提示氧供不足。
血乳酸是反映组织是否处于低灌注状态和是否缺氧的灵敏指标,如乳酸水平高于4mmol/L时死亡率明显升高。而动态监测血乳酸变化或计算乳酸清除率对疾病状态的评估更有价值。
组织氧代谢
脓毒症导致的胃肠道血流低灌注可导致其黏膜细胞缺血缺氧,H+释放增加与CO2积聚。消化道黏膜pH值(pHi)是目前反映胃肠组织细胞氧合状态的指标。
早期液体复苏
在脓毒症中,由于血管收缩舒张功能异常和通透性增加,机体在早期就出现了血容量降低,组织器官出现低灌注状态,因此及时进行有效液体复苏成为脓毒症治疗的关键措施。
有证据表明,早期液体复苏有助于改善脓毒症休克患者的预后,脓毒症治疗指南也提出脓毒症早期目标指导性治疗(EGDT)策略,提出6h内应达到:
中心静脉压(CVP)8~12mmHg;
平均动脉压(MAP)≥65mmHg;
尿量≥0.5ml/kg/h;
ScvO2≥70%或SvO2≥65%。
血管活性药物
血管活性药物的应用,最好在便于进行血流动力学监测的ICU内进行。
如果液体复苏后仍不能使患者的血压和脏器低灌注状态得到改善,则应给与血管活性药物升压治疗,而如果患者面临威胁生命的休克时,即使其低容量未被纠正,此时亦应该给予升压治疗。
对于出现脓毒性休克的患者,去甲肾上腺素和多巴胺是首选药物,此外亦可选择多巴酚丁胺、血管加压素等。
对于出现心脏低心输出量时,多巴酚丁胺是首选的心肌收缩药物。
需要注意的是,如果患者处于严重代谢性酸中毒情况下(PH<7.15),使用血管活性药物效果往往欠佳,需积极纠正酸中毒。
严重脓毒症和脓毒症患者往往存在肾上腺皮质功能不全,因此对于经液体复苏后仍需给予升压药物维持血压的患者,可以考虑给予小剂量的糖皮质激素治疗,通常选择氢化可的松,每日剂量在200~300mg范围。
机械通气辅助通气
对严重脓毒症患者,在出现急性肺损伤/急性呼吸窘迫综合征(ALI/ARDS)时,应及时进行机械通气治疗以缓解组织缺氧状态,并且建议选择低平台压、小潮气量通气、允许性高碳酸血症的保护性肺通气策略。
血糖控制
脓毒症患者存在胰岛素抵抗情况,而循证医学证实脓毒症患者的血糖过高是其不良预后的危险因素,因此应把脓毒症患者的血糖应控制在合理的水平(<8.3mmol/L),但同时应注意防止患者发生低血糖,因此应加强血糖监测。既往强调脓毒症患者进行强化血糖控制,但近年来的研究证实,强化血糖控制并未显著降低患者的整体病死率,反而容易导致严重的低血糖发生。
此外,可给予适当镇静,加强肾脏、肝脏等脏器支持,防止出现应激性溃疡、深静脉血栓、DIC等并发症的治疗。活化蛋白C在国外已用于治疗脓毒症。
早期目标指导性治疗和集束化治疗
为了更好的落实脓毒症治疗指南,规范严重脓毒症和脓毒性休克的治疗,目前推荐将上述脓毒症治疗指南的重要措施进行组合,形成一套措施,即早期目标指导性治疗和集束化治疗。
早期目标指导性治疗(EGDT)
一旦临床诊断严重脓毒症合并组织灌注不足,应尽快进行积极的液体复苏,并在出现血流动力学不稳定状态的最初6h内达到以下目标:
中心静脉压8~12mmHg;
中心静脉氧饱和度(ScvO2)≥70%;
平均动脉压(MAP)≥65mmHg;
尿量>0.5ml/kg/h。
早期集束化治疗(sepsisbundle)
早期血清乳酸水平测定;
在应用抗生素前获取病原学标本;
急诊在3h内、ICU在1h内开始广谱抗生素治疗;
执行EGDT并进行血流动力学监测,在1~2h内放置中心静脉导管,监测CVP和ScvO2;
控制过高血糖;
小剂量糖皮质激素应用;
机械通气平台压<30mmHg及小潮气量通气等肺保护策略;
有条件可使用rhAPC。
早期集束化治疗策略的实施,有助于提高临床医师对脓毒症治疗指南的认知和依从性,并取得较好的临床疗效。但是,近年来不同的研究者从不同角度对集束化治疗提出疑问,而且集束化治疗容易忽视脓毒症患者个体化差异。
由于脓毒症的根本发病机制尚未阐明,因此,判断集束化治疗的综合收益/风险并非轻而易举,期待更多的临床偱证医学研究和国际国内合作研究对其进行评估和完善。
脓毒症病情凶险,病死率高,大约有9%的脓毒症患者会发生脓毒性休克和多器官功能不全,重症监护室中一半以上的死亡是由脓毒性休克和多器官功能不全引起的,脓毒症成为重症监护病房内非心脏患者死亡的主要原因。
研究表明,出现脏器器官衰竭、休克、多重感染、严重的潜在疾病的患者预后较差。
并发症
脓毒症的并发症实质是脓毒症病理生理各阶段过程中的临床表现,常见的并发症包括:
休克;
急性呼吸窘迫综合症;
深静脉血栓形成;
应激性溃疡;
弥漫性血管内凝血(DIC)直至多器官功能不全。
掌握其发病机制有助于更好的防治其并发症。