-
等电点 编辑
等电点(pI,isoelECTric point)
例如:在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,所带净电荷为零,呈电中性,此时溶液的pH称为该氨基酸的等电点。两性离子所带电荷因溶液的pH值不同而改变,当两性离子正负电荷数值相等时,溶液的pH值即其等电点。
当外界溶液的pH大于两性离子的pI值,两性离子释放质子带负电。
当外界溶液的pH小于两性离子的pI值,两性离子质子化带正电。
当达到等电点时氨基酸在溶液中的溶解度最小。
氨基酸具有氨基和羧基的典型反应,例如氨基可以羟基化、酰基化,可与亚硝酸作用;羧基以成酯或酰氯或酰胺等。此外,由于分子中同时具有氨基与羧基,还有氨基酸所特有的性质。
氨基酸分子中既含有氨基,又含有羧基,所以氨基酸与强酸强碱都能成盐,氨基酸是两性物质,本身能形成内盐。
氨基酸的高熔点(实际为分解点)、难溶于非极性有机溶剂等性质说明氨基酸在结晶状态是以两性离子存在的。
在水溶液中,氨基酸二偶极离子既可以与一个H+结合成为正离子,又可以失去一个H+成为负离子。这三种离子在水溶液中通过得到或失去互相转换同时存在,在pH值达到等电点时溶液处于平衡。
等电点不是中性点,不同氨基酸由于结构不同,等电点也不同。酸性氨基酸水溶液的等电点必然小于7,所以必须加入较多的碱才能使正负离子量相等。反之,碱性氨基酸水溶液中负离子较多,则必须加入酸,才能使正离子量增加。所以碱性氨基酸的等电点必然大于7。
各种氨基酸在其等电点时,溶解度最小,因而用调节等电点的方法,可以分离氨基酸的混合物。
氨基酸形成内盐
氨基酸的晶体是以偶极离子的形式存在。
这种偶极离子是分子内的氨基与羧基成盐的结果,故又叫内盐。
核酸的等电点比较低。如DNA的等电点为4~4.5,RNA的等电点为2~2.5。
等电点
在氨基酸溶液中存在如下平衡,在一定的pH值溶液中,正离子和负离子数量相等且浓度都很低,而偶极浓度最高,此时电解以偶极离子形式存在,氨基酸不移动。这时溶液的pH值便是该氨基酸的等电点。
使用该分子的酸度系数可以计算一个只带一个胺基和一个羧基的氨基酸的等电点。
即:
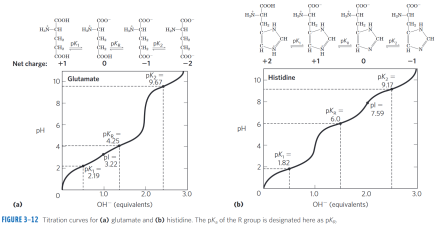
对于中性氨基酸,pI=1/2(pK1+pK2) 。例如:Gly pI=1/2(2.34+9.60)=5.97。
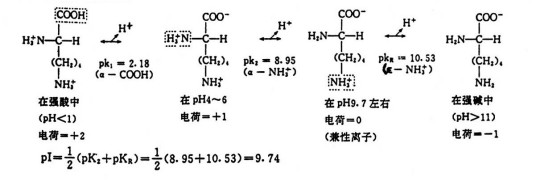
对于酸碱性氨基酸,其等电点pI=1/2(pK1+pKR)。例如:Tyr pI=1/2(2.20+10.7)=5.66。不过更加精确的计算需要对酸和碱方面有更深入的知识
中性氨基酸的羧基解离程度大于氨基,故其pI偏酸,pI值略小于7.0;酸性氨基酸的羧基解离程度更大,pI明显小于7.0;碱性氨基酸的氨基解离程度明显大于羧基等,故其pI大于7.0;在一定的pH条件下,氨基与羧基的解离程度相等,静电荷为零,此时溶液的pH即为其等电点。
蛋白质的沉淀
同种蛋白质在水溶液中带有同种电荷,互相排斥,且蛋白质表面能形成水化膜,这就使得蛋白质溶液(实际上是胶体)十分稳定。要想破坏其稳定性让其沉淀则需要从这两方面入手,也就是除去水化膜和表面电荷。
比如,可以先将蛋白质的pH调整至等电点,这时的蛋白质分子呈等电状态,虽不很稳定,但还有水膜的保护作用,一般不致沉淀,如果这时加入脱水剂除去蛋白质分子的水膜,则蛋白质分子互相凝聚、沉淀析出。先脱水,后调节pH到等电点,也同样可使蛋白质沉淀。
利用蛋白质的沉淀这一性质可以分离制备氨基酸
蛋白质的电泳
当蛋白质不处于等电点状态时其总是带有一定电荷的,可以利用此特性使其电泳。还可以通过调节电泳液的pH来控制蛋白质的电泳方向和速度。
陶瓷材料
在材料科学里在许多水处理过程中使用金属氧化物的等电点。这些物质在水里一般认为其表面覆盖了一层表面氢氧基。pH值高于等电点时其表面主要覆盖的是M-O,在pH值低于等电点时其表面主要覆盖的是M-OH。根据材料因素如纯度、物相以及物理因素如温度不同这些值可能出入很大。等电点的精确测量需要非常仔细的操作和现代化的技术。
蛋白质 等电点(参考值)
蛋白质 等电点
鲑精蛋白 12.1
鲱精蛋白 12.1
鲟精蛋白 11.71
珠蛋白(人) 7.5
卵白蛋白 4.71; 4.59
伴清蛋白 6.8;7.1
血清白蛋白 4.7-4.9
肌清蛋白 3.5
肌浆蛋白 6.3
β-乳球蛋白 5.1-5.3
卵黄蛋白 4.8-5.0
γ1—球蛋白(人) 5.8;6.6
γ2—球蛋白(人) 7.3;8.2
肌球蛋白A 5.2-5.5
原肌球蛋白 5.1
铁传递蛋白 5.9
胎球蛋白 3.4-3.5
血纤蛋白原 5.5-5.8
α-眼晶体蛋白 4.8
β-眼晶体蛋白 6
花生球蛋白 5.1
伴花生球蛋白 3.9
角蛋白类 3.7-5.0
还原角蛋白 4.6-4.7
胶原蛋白 6.5-6.8
鱼胶 4.8-5.2
白明胶 4.0-4.1
α-酪蛋白 4.0-4.1
β-酪蛋白 4.5
γ-酪蛋白 5.8-6.0
α-卵清粘蛋白 3.83-4.41
α1-粘蛋白 1.8-2.7
卵黄类粘蛋白 5.5
肌红蛋白 6.99
血红蛋白(人) 7.07
血红蛋白(鸡) 7.23
血红蛋白(马) 6.92
血蓝蛋白 4.6-6.4
蚯蚓血红蛋白 5.6
血绿蛋白 4.3-4.5
无脊椎血红蛋白 4.6-6.2细胞色素C 9.8-10.1
视紫质 4.47-4.57
α1-脂蛋白 5.5
β1-脂蛋白 5.4
β-卵黄脂磷蛋白 5.9
芜菁黄花病毒 3.75
牛痘病毒 5.3
生长激素 6.85
催乳激素 5.73
胰岛素 5.35
糜蛋白酶(胰凝乳蛋白酶) 8.1
牛血清白蛋白 4.9
核糖核酸酶(牛胰) 7.8
甲状腺球蛋白 4.58
胸腺核组蛋白 4左右