-
α-螺旋 编辑
生物化学名词
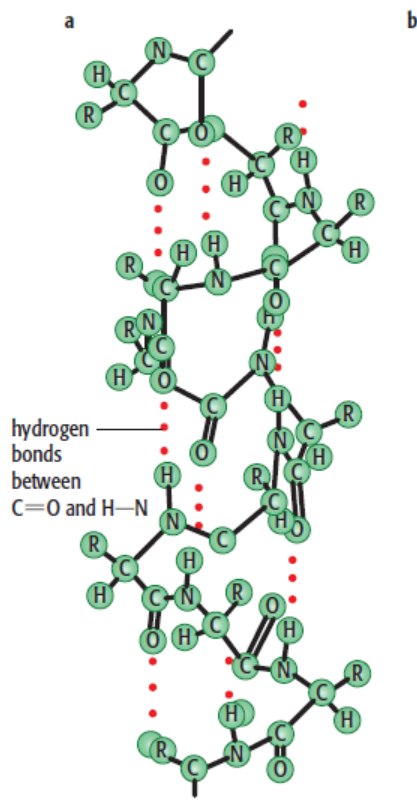
α-螺旋(α-helix)是蛋白质二级结构的主要形式之一。指多肽链主链围绕中心轴呈有规律的螺旋式上升,每3.6 个氨基酸残基螺旋上升一圈,向上平移0.54nm,故螺距为0.54nm,两个氨基酸残基之间的距离为0.15nm。螺旋的方向为右手螺旋。氨基酸侧链R基团伸向螺旋外侧,每个肽链的肽键的羰基氧和第四个N-H形成氢键,氢键的方向与螺旋长轴基本平行。由于肽链中的全部肽键都可形成氢键,故α-螺旋十分稳定。
①肽链以螺旋状盘卷前进,每圈螺旋由3.6个氨基酸构成,螺圈间距(螺距)为5.44埃;②螺旋结构被规则排布的氢键所稳定,氢键排布的方式是:每个氨基酸残基的N—H与其氨基侧相间三个氨基酸残基的C=O形成氢键。这样构成的由一个氢键闭合的环,包含13个原子。因此,α-螺旋常被准确地表示为3.6/13螺旋。螺旋的盘绕方式一般有右手旋转和左手旋转,在蛋白质分子中实际存在的是右手螺旋。
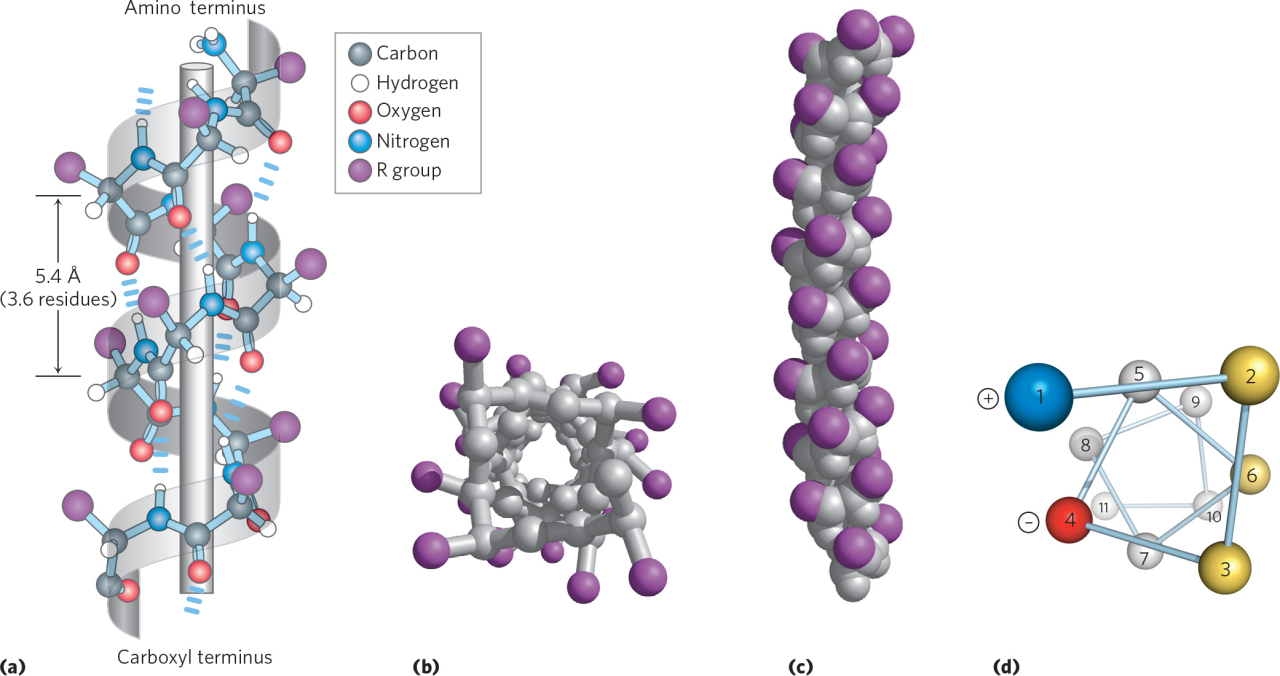 α-螺旋的结构
α-螺旋的结构
①侧链基团的电荷性质和大小都有影响,甘氨酸由于侧链太小,构象不稳定,是α螺旋的破坏者;② 连续存在带相同电荷的氨基酸残基;③ 不存在脯氨酸残基,脯氨酸由于其亚氨基少一个氢原子,无法形成氢键,而且Cα-N键不能旋转,所以是α螺旋的破坏者,肽链中出现脯氨酸就中断α螺旋,形成一个“结节”。
α-螺旋中所有氢键都沿螺旋轴指向同一方向。每一肽键都有由N-H和C=O的极性产生的偶极距。