-
壁细胞 编辑
目录
壁细胞亦称泌酸细胞
哺乳动物壁细胞可接受不同促分泌因子的刺激,通过第二信使转导,经H/K-ATP酶分泌HCl.膜包裹的H/K-ATP酶,利用ATP级链水解释放的能量,将细胞内的H+单向转运出胞外,并将细胞外的K转运进胞内。K不能通过胞质颗粒膜,而存在于细胞分泌微管中,通过具有Cl-通道和KCl的共转运通路,使得K和Cl-排出细胞外,然后K通过H/K-ATP酶再循环进入细胞内,并同时将H分泌入微管中。人体中仅胃H/K-ATP酶具有这种独特的结构和交换机制,并且只有胃H/K-ATP酶能够使腔内pH降低至4以下。Cl-通道是H/K-ATP酶功能的组成部分。胃肠道各类效应器细胞和释放神经递质的神经末梢中,广泛地存在着各种受体。壁细胞中除传统的胆碱能、胃泌素、组胺H2等受体,也存在前列腺素E受体亚型、生长抑素受体亚型、白介素-1受体亚型等受体。壁细胞的分泌功能可被乙酰胆碱、胃泌素、组胺H2受体的任一受体拮抗剂所阻滞。组胺H2受体是一个70 kDA的糖蛋白,具有7跨膜域/G蛋白耦联受体结构。组胺通过位于胃黏膜细胞表面的组胺H2受体介导,激活腺苷酸环化酶,其所产生的cAMP,对于与H/K-ATP酶相联系的膜上Cl-通道开放,起着关键作用。乙酰胆碱受体和胃泌素受体功能由Ca介导,前列腺素E2则通过参与腺苷酸环化酶对组胺激活的作用,介导拮抗分泌的功能。胃泌素受体和乙酰胆碱受体除表达于壁细胞之外,还表达于分泌生长抑素的D细胞、和分泌组胺的ECL细胞。
ECL细胞、G细胞、D细胞是胃内主要的分泌细胞,在壁细胞外周部,通过刺激性或抑制性旁分泌、内分泌、神经性通路作用,调节胃酸分泌。这三种细胞功能的整合,是决定壁细胞刺激程度的初始因素。胃泌素CCK-B受体激活、b肾上腺素能受体激活、以及部分ECL细胞中的乙酰胆碱受体激活,使ECL细胞功能向上调节。胃泌素和乙酰胆碱导致典型双相Ca信号的产生。生长抑素与生长抑素2型受体作用、组胺与组胺3型受体作用、以及肽PYY的作用,抑制ECL细胞释放组胺及抑制Ca信号。ECL细胞受刺激后激活Cl-通道、K通道,电压依赖Ca通道与受体操纵Ca通道。D细胞可被胃泌素或CCK激活,也可被乙酰胆碱和生长抑素抑制。G细胞可被乙酰胆碱和胃泌素释放肽(GRP)激活,也可被生长抑素抑制。
Gillen等的深入研究,以DU(Hp+)、健康志愿者(Hp-)和健康志愿者(Hp+)等三组为观察对象,比较其静脉滴注胃泌素时,获得的最大泌酸量(MAO)及其对胃泌素的敏感性(50%MAO所需的血清胃泌素浓度);结果为,前两组的胃泌素敏感性数值无统计学意义,第三组的血清胃泌素浓度值明显升高,较其他两组的敏感性显著减低(p<0.0003);而MAO在DU组高于其他两组健康志愿者。结论为,Hp(+)性健康志愿者的胃泌素敏感性减低,DU患者的最大泌酸能量增加,与Hp所引致的高胃泌素血症有因果关系11i。Hp感染导致的高胃泌素血症可能存在许多值得探讨的机制。
为了去除DU病人壁细胞、ECL细胞数量过大的干扰,Hurlimann等研究非溃疡病病人;按Hp(+)和Hp(—)分为两组,观察其慢性胃炎、五肽胃泌素—胃液分析和饮食刺激—血浆胃泌素释放;结果为,Hp(+)胃炎显著(积分高,有意义);其余BAO(基础胃酸分泌)、PAO(高峰胃酸分泌)、MAO、五肽胃泌素的ED50(半数有效剂量)和血浆胃泌素值等,两组均无差异;且与胃炎积分无一致性;但其主要发现是,lip(+)者的PALO和MAO,有相当大的变异,>50%的病例高于或低于lip(—)者较低的数值范围。结论是,在非溃疡病病人,Hp(+)引起的胃炎并不规律性地增大MAO,也不影响其壁细胞对胃泌素的敏感性;因而推测,lip感染不可能对DU的这些指标增高负责;本文认为,慢性lip感染,在某些特定的小组人群中,可能有MAO加强或减弱。文献上考虑溃疡病和慢性胃炎的BAO、MAO和血清胃泌素等水平时,强调同时注意胃炎的范围和程度,及其可能破坏壁细胞、G细胞,甚至ECL细胞的程度,以避免片面性 。
0
有用+1
已投票
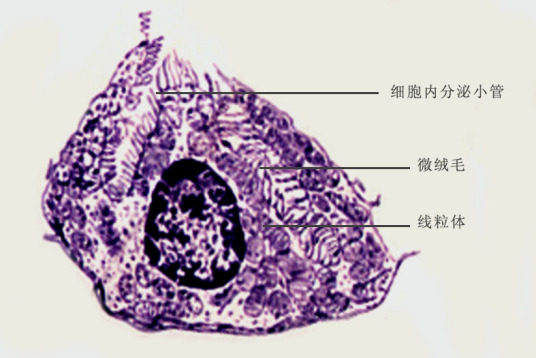
壁细胞(parietal cell)又称泌酸细胞(oxyntic cell),在腺的颈、体部较多。此细胞较大,多呈圆锥形。核圆而深染,居中,可有双核;胞质呈均质而明显的嗜酸性。电镜下,壁细胞胞质中有迂曲分支的细胞内分泌小管(intracellular secretory canaliculus),管壁与细胞顶面质膜相连,并都有微绒毛。壁细胞是胃中的泌酸腺体,壁细胞(parietal cell)的超微结构:微绒毛,细胞内分泌小管,细胞核。
壁细胞亦称泌酸细胞( oxyntic cell),位于胃腺颈部,凸入腺腔。在未受刺激时,胞颈黏液细胞质内有许多管状泡囊,顶端有分泌小管其内璧有许多微绒毛,受刺激时细胞内的分泌小管即时形成一致密的网络而管壁细胞状泡囊消失。微绒毛内有很多肌动蛋白组成的微丝,盐酸由小管顶端表面分泌酸分泌为一主动转运过程,需要很多能内分泌细胞量,而这能量由壁细胞内的线粒体提供 。
胃粘膜中有三种外分泌腺:贲门腺、泌酸腺和幽门腺,其中的泌酸腺的腺体主要就有壁细胞、主细胞和颈粘液细胞,壁细胞能分泌盐酸和内因子。分泌小管周围有表面光滑的小管和小泡,称微管泡系统(tubulovesicular system),其膜结构与细胞顶面及分泌小管相同。
壁细胞的此种特异性结构于细胞的不同分泌时相而呈显著差异。在非分泌时相,分泌小管多不与胃底腺腔相通,小管与细胞顶面的微绒毛短而稀疏,微管泡系统却极发达;在分泌时相,分泌小管开放,微绒毛增多并变长,充填在分泌小管管腔内,使细胞游离面扩大约5倍,而微管泡系统的管泡数量则剧减。这表明微管泡系统实为分泌小管的膜之储备形式。壁细胞还有大量线粒体,其它细胞器则较少。
胃肠道各类效应器细胞和释放神经递质的神经末梢中,广泛地存在着各种受体。壁细胞中除传统的胆碱能、胃泌素、组胺H2等受体,也存在前列腺素E受体亚型、生长抑素受体亚型、白介素-1受体亚型等受体。壁细胞的分泌功能可被乙酰胆碱、胃泌素、组胺H2受体的任一受体拮抗剂所阻滞。组胺H2受体是一个70 kDa的糖蛋白,具有7跨膜域/G蛋白耦联受体结构。组胺通过位于胃黏膜细胞表面的组胺H2受体介导,激活腺苷酸环化酶,其所产生的cAMP,对于与H/K-ATP酶相联系的膜上Cl-通道开放,起着关键作用。乙酰胆碱受体和胃泌素受体功能由Ca介导,前列腺素E2则通过参与腺苷酸环化酶对组胺激活的作用,介导拮抗分泌的功能。胃泌素受体和乙酰胆碱受体除表达于壁细胞之外,还表达于分泌生长抑素的D细胞、和分泌组胺的ECL细胞。
ECL细胞、G细胞、D细胞是胃内主要的分泌细胞,在壁细胞外周部,通过刺激性或抑制性旁分泌、内分泌、神经性通路作用,调节胃酸分泌。这三种细胞功能的整合,是决定壁细胞刺激程度的初始因素。胃泌素CCK-B受体激活、b肾上腺素能受体激活、以及部分ECL细胞中的乙酰胆碱受体激活,使ECL细胞功能向上调节。胃泌素和乙酰胆碱导致典型双相Ca信号的产生。生长抑素与生长抑素2型受体作用、组胺与组胺3型受体作用、以及肽PYY的作用,抑制ECL细胞释放组胺及抑制Ca信号。ECL细胞受刺激后激活Cl-通道、K通道,电压依赖Ca通道与受体操纵Ca通道。D细胞可被胃泌素或CCK激活,也可被乙酰胆碱和生长抑素抑制。G细胞可被乙酰胆碱和胃泌素释放肽(GRP)激活,也可被生长抑素抑制。
Gillen等的深入研究,以DU(Hp+)、健康志愿者(Hp-)和健康志愿者(Hp+)等三组为观察对象,比较其静脉滴注胃泌素时,获得的最大泌酸量(MAO)及其对胃泌素的敏感性(50%MAO所需的血清胃泌素浓度);结果为,前两组的胃泌素敏感性数值无统计学意义,第三组的血清胃泌素浓度值明显升高,较其他两组的敏感性显著减低(p<0.0003);而MAO在DU组高于其他两组健康志愿者。结论为,Hp(+)性健康志愿者的胃泌素敏感性减低,DU患者的最大泌酸能量增加,与Hp所引致的高胃泌素血症有因果关系11i。Hp感染导致的高胃泌素血症可能存在许多值得探讨的机制。
为了去除DU病人壁细胞、ECL细胞数量过大的干扰,Hurlimann等研究非溃疡病病人;按Hp(+)和Hp(—)分为两组,观察其慢性胃炎、五肽胃泌素—胃液分析和饮食刺激—血浆胃泌素释放;结果为,Hp(+)胃炎显著(积分高,有意义);其余BAO(基础胃酸分泌)、PAO(高峰胃酸分泌)、MAO、五肽胃泌素的ED50(半数有效剂量)和血浆胃泌素值等,两组均无差异;且与胃炎积分无一致性;但其主要发现是,lip(+)者的PALO和MAO,有相当大的变异,>50%的病例高于或低于lip(—)者较低的数值范围。结论是,在非溃疡病病人,Hp(+)引起的胃炎并不规律性地增大MAO,也不影响其壁细胞对胃泌素的敏感性;因而推测,lip感染不可能对DU的这些指标增高负责;本文认为,慢性lip感染,在某些特定的小组人群中,可能有MAO加强或减弱。文献上考虑溃疡病和慢性胃炎的BAO、MAO和血清胃泌素等水平时,强调同时注意胃炎的范围和程度,及其可能破坏壁细胞、G细胞,甚至ECL细胞的程度,以避免片面性 。