-
蛋白激酶C 编辑
在生物化学中,PKC家族由15种人类的同工酶组成。根据其第二信使,它们被分为三个亚家族:传统型(或经型)、新型和非典型。传统型(c)PKCs含有α、βI、βII和γ亚型。它们需要Ca2+、DAG和磷脂例如磷脂酰丝氨酸来激活。新型(n)PKCs包括δ、ε、η和θ亚型,需要DAG,但不需要Ca2+激活。因此,传统型和新型PKCs通过与磷脂酶C相同的信号转导途径被激活。另一方面,非典型(a)PKCs(包括蛋白激酶Mζ和ι/λ亚型)既不需要Ca2+也不需要二酰甘油来激活。蛋白激酶C通常指整个亚型家族。在有颌脊椎动物中发现的不同种类的PKC源自5个祖先PKC家族成员(PKN、aPKC、cPKC、nPKCE、nPKCD),这些家族成员由于基因组复制而扩大。更广泛的PKC家族是古老的,可以在真菌中找到,这意味着PKC家族存在于后鞭毛生物(opisthokonts.)的最后一个共同祖先中。
PKC亚类的分子结构
PKC的所有亚类都由一条单肽链组成(图8-11),分子量大约为67-83kDa,其结构可分为四个保守区C1-C4(mPKC和aPKC缺少C2区)和五个可变区V1-V5。基中C1区可能是膜结合区,并且含有富含半胱氨酸的随机重复序列Cys-X2-Cys-X13(14)-Cys-X2-Cys-X7-Cys-X7-Cys(X代表任何一种氨基酸),这段顺序与在许多金属-蛋白质及转录调节有关的DNA结合蛋白中的半胱氨酸-锌-DNA结合指形区(cysteine-Zinc-DNabinding finger)保守顺序Cys-X2-Cys-X13-Cys-X2-Cys相似。对PKC的多肽片段进行分析发现,该序列与佛波酯和二酰基甘油(DAG)的结合有关。C2区与PKC对Ca2+的敏感性有关。C1和C2在结构上不同于其它蛋白激酶,能结合Ca2+、磷脂、DAG和TPA,因此C1和C2区又称为调节区。C3区包括一个ATP结合序列Gly-X-Gly-X-X-Gly-Lys,该区域与其它蛋白激酶的ATP结合位点具有很高的同源性,又称催化区。C4区包含一个底物结合区,是识别磷酸化底物所必需的。
已发现了至少11种亚型,其结构有一定的保守性而又有所差别,导致其功能和调控的多样性。新合成的PKC一般需要经历活化茎环(ACTivation-loop,A-loop)、转角模体(Turn motif,TM)以及疏水模体(hydrophobic motif,HM)的程序性磷酸化过程才能成熟,获得进一步活化的功能。催化区在不同亚型中高度保守,且较小程度地在其他丝氨酸/苏氨酸激酶的催化区中也高度保守。异构体中的第二信使需求差异是调控结构域的结果,这些区域在类内相似,但在类之间不同。除了PKC-θ和PKC-ι外,PKC催化区的大部分晶体结构尚未确定。但由于其与已确定晶体结构的其他激酶相似,因此可以很好地预测其结构。转位
PKC广泛分布于多种组织、器官和细胞,静止细胞中PKC主要存在于胞浆中,当细胞受到刺激后,PKC以Ca2+依赖的形式从胞浆中移位到细胞膜上,此过程称之为转位(translocation)。一般将PKC的转位作为PKC激活的标志。
调控
PKC的调控结构域或氨基末端包含几个共享的亚区。C1结构域存在于PKC的所有亚型中,具有DAG以及称为佛波酯(phorbol esters)的不可水解的非生理性类似物的结合位点。该结构域是功能性的,在传统型和新型PKC中都能与DAG结合,然而,非典型PKC中的C1结构域不能结合DAG或佛波酯。C2结构域充当Ca2+传感器,存在于传统型和新型中,但仅在传统型中起Ca2+传感器的作用。假底物区存在于所有三类PKC中,是一个小的氨基酸序列,模拟底物并结合催化域中的底物结合位点,缺少关键的丝氨酸、苏氨酸磷酸受体残基,保持酶的活性。当Ca2+和DAG以足够的浓度存在时,它们分别与C2和C1结构域结合,并将PKC招募到膜上。这种与膜的相互作用导致假底物从催化位点释放并激活酶。然而,为了使这些变构相互作用发生,PKC必须首先被恰当地折叠,并且处于允许催化作用的正确构象。这取决于催化区域的磷酸化。
激活
PKC的活性依赖于钙离子和磷脂的存在,但只有在磷脂代谢中间产物二酰基甘油(DAG)存在下,生理浓度的钙离子才起作用,这是由于DAG能增加PKC对底物亲和力的缘故。磷脂酰肌醇-4,5-二磷酸(PIP2)在磷脂酶-C作用下水解生成DAG和IP3。IP3促进细胞内钙离子的释放,在激活PKC过程中与DAG起协同作用。乙酸豆塞外佛波酯(12-o-tERTradecaNOylphordol-13-acetate,TPA;或phorbol-12-myriSTATe-13-acetate,PMA)是一种促肿瘤剂,由于基结构与DAG相似,可在很低浓度下模拟DAG,活化PKC,使PKC亲和力增至10-7M。PKC是TPA的受体,当TPA插入细胞膜后可以替代DAG而直接活化PKC。当过高剂量TPA处理细胞可使靶细胞中PKC迅速耗竭,反而影响细胞的信号传递。
多种化学物持或抗生素对PKC活性具有抑制作用,根据抑制剂作用PKC靶部位的不同可以将抑制剂分为二组:一组是作用于催化区的抑制剂,它们可与蛋白激酶的保守残基结合,因此对PKC无明显的选择性;另一组是作用于调节区的抑制剂,它们可与Ca2+、磷脂和二酰基甘油/佛波酯相结合,因而有较高的选择性 。
激活后,PKC通过RACK蛋白(活化PKC的膜结合受体)转移至质膜。PKC因其长期激活而闻名:它们在原始激活信号或Ca2+波消失后仍保持激活。据推测,这是通过磷脂酶从磷脂酰肌醇生产DAG来实现的;脂肪酸也可能在长期激活中发挥作用。PKC激活的关键部分是向细胞膜的易位。有趣的是,这一过程在微重力环境中会被破坏,从而导致宇航员免疫缺陷。
催化
PKC的催化区或激酶核心能够执行不同的功能。PKB(也称为Akt)和PKC含有约40%的氨基酸序列相似性,这种相似性在PKC之间增加到约70%,在类内进行比较时甚至更高。例如,ζ和ι/λ这两种非典型PKC亚型的同源性为84%。在已揭示晶体结构的30多个蛋白激酶结构中,所有结构都具有相同的基本结构,即双叶结构(bilobalstructure),具有由N端叶组成的β折叠和由C端叶构成的α螺旋。ATP结合蛋白(ATP)和底物结合位点都位于这两个末端叶形成的缝隙中。这也是调节区的假底物结构域结合的地方。
PKC催化区的另一个对激酶活性至关重要的特征是其磷酸化。传统型和新型PKC有三个磷酸化位点,称为:激活环、转向基序和疏水基序(the activationloop, the turn motif, and the hydrophobic motif)。非典型PKCs仅在激活环和转向基序上磷酸化。由于带负电荷而与磷酸化氨基酸残基具有相似作用效果的谷氨酸代替了丝氨酸,疏水基序的磷酸化变得不必要。这些磷酸化过程对酶的活性至关重要,3-磷酸腺苷依赖性蛋白激酶-1(PDPK1)是上游激酶,负责通过激活环的转磷酸化启动该过程。
PKC的共有序列与PKA相似,因为它含有类似Ser/Thr等要被磷酸化的的碱性氨基酸。它们的有MARCKS蛋白、MAP激酶、转录因子抑制剂IκB、维生素D3受体VDR、Raf激酶、钙蛋白酶和表皮生长因子受体等。
蛋白激酶C是一种细胞质酶,在未受刺激的细胞中,PKC主要分布在细胞质中, 呈非活性构象。一旦有第二信使的存在,PKC将成为膜结合的酶,它能激活细胞质中的酶,参与生化反应的调控, 同时也能作用于细胞核中的转录因子, 参与基因表达的调控, 是一种多功能的酶。 比较常见的有PKC参与受体脱敏、调节膜结构、调节转录、介导免疫应答、调节细胞生长以及学习和记忆等。这些功能是通过PKC介导的其他蛋白质的磷酸化来实现的。PKC通过CARD-CC家族蛋白的磷酸化和随后的NF-κB活化在免疫系统中发挥重要作用。然而,由于不同种类的细胞之间的蛋白表达不同,磷酸化的底物蛋白不同,因此,PKC的作用是细胞类型特异性的。
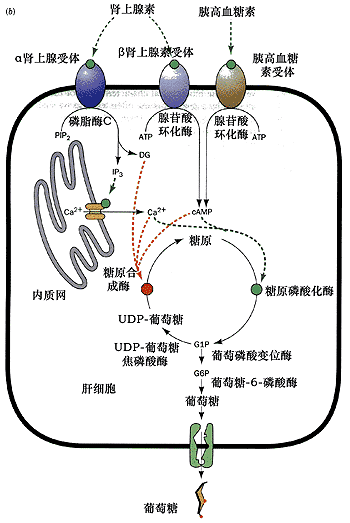
对糖代谢的控制
在肝细胞中, 蛋白激酶C与蛋白激酶A协作磷酸化糖原合成酶,抑制葡萄糖聚合酶(glucose-polymerizing enzyme)的活性,促进糖原代谢
cAMP介导的促进糖原分解、抑制糖原合成作用是由胰高血糖素受体和β肾上腺素受体结合了相应激素所引起;而IP3、DAG和Ca2+介导的促进糖原分解和抑制糖原合成的是由α肾上腺受体结合肾上腺素所引起。cAMP激活蛋白激酶A,而IP3、DAG和Ca2+ 激活蛋白激酶C.
对细胞分化的控制
肌细胞生成素是一种转录因子,在肌细胞分化中起关键作用。在成肌细胞(myoblast)中, 蛋白激酶C可使肌细胞生成素磷酸化,抑制了肌细胞生成素与DNA结合的能力,因而阻止了细胞分化为肌纤维。
参与基因表达调控
蛋白激酶C至少可通过两种途径参与基因表达的控制。一种途径是蛋白激酶激活一个磷酸化的级联系统,使MAP蛋白激酶磷酸化,磷酸化的MAP蛋白激酶将基因调节蛋白Elk-1磷酸化,使之激活。激活了Elk-1与一个短的DNA序列(称为血清反应元件,SRE)结合,然后与另一个因子(血清反应因子,SRF)共同调节基因表达。另一种途径是蛋白激酶磷酸化并激活抑制蛋白Iκ-B,释放基因调节蛋白NF-κ-B,使之进入细胞核激活特定基因的转录。
参与长时程抑制(LTD)
小脑长时程抑制LTD是由于PKC激活间接或直接引起AMPA受体的磷酸化,使AMPA受体转化为稳定的失敏状态或使受体发生内化,结果导致LTD
此外
有人认为PKC能够催化未被其他激酶催化的蛋白,如催化与分泌和增殖有关的蛋白磷酸化。还可以活化Na+-K+交换系统、使细胞内H+减少、提高细胞质中的pH,还可以提高Na+/K+泵的运转等。 蛋白激酶C在细胞的生长、分化、细胞代谢以及转录激活等方面具有非常重要的作用 。PKC的活性下降与肿瘤也有密切关系。
病理学
由肿瘤启动子佛波酯激活的PKC可能会磷酸化有效的转录激活剂,从而导致癌基因表达增加,加速癌症发展或干扰其他现象。然而,长时间暴露于佛波酯会导致PKC的下调。功能缺失突变和低PKC蛋白水平在癌症中普遍存在,表明PKC的肿瘤抑制作用。
蛋白激酶C酶是血管通透性的重要介质,并与各种血管疾病有关,包括糖尿病等相关疾病,以及与吸烟相关的内皮损伤和组织损伤。低水平PKC活性能通过磷脂酰肌醇3-激酶/AKT信号逆转细胞手性,并改变具有相反手性的细胞之间的连接蛋白组织,导致内皮通透性发生意外的性质变化,从而可能导致炎症和疾病。
抑制剂
PKC抑制剂,如卢布司他林(ruboxistaurin),可能对周围型糖尿病肾性病有益。天然存在的PKC抑制剂有车红素、米雅酚C、肉豆蔻醇、棉酚等。其他PKC抑制剂还包括:Verascoside、BIM-1、Ro31-8220、苔藓抑素1(Bryostatin 1)、他莫昔芬(Tamoxifen)等,其中有些已进行了抗肿瘤相关的研究。
激活剂
蛋白激酶C激活剂丁烯酸酯(ingenol mebutate)来源于南欧大戟Euphorbia peplus,已被批准用于光化性角化病的治疗。除了抑制剂外,苔藓抑素也可以作为PKCe激活剂,正在研究对阿尔茨海默病的作用。12-O-十四烷酰佛波醇-13-乙酸酯(PMA或TPA)是一种可以激活传统型PKC的二酰基甘油模拟物,它通常与离子霉素一起使用,离子霉素提供激活某些PKC所需的钙依赖性信号。