-
溶解热 编辑
物理、化学热量术语
在特定条件下一定量溶质溶于一定量溶剂时产生的热效应。影响物质溶解热的主要因素有温度、压力、溶质量和溶剂量。溶解热通常用298.15K和1大气压下1摩尔溶质溶于一定量溶剂的热效应来表示,单位为焦/摩尔。根据物质溶解过程中溶液浓度是否发生变化,溶解热又可分为积分溶解热和微分溶解热,前者是1摩尔溶质溶解在n摩尔溶剂中所产生的热效应,在溶解过程中溶液浓度逐渐改变 。微分溶解热是一种定浓度的溶解热,可以认为是把1摩尔溶质溶于大量的、一定浓度的溶液时所产生的热效应,或者在一定量溶液中加入极少量的dn摩尔溶质时产生的热效应。积分溶解热与微分溶解热的关系表示为:
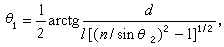 、
、
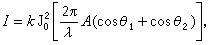
如果考虑一个在恒温恒压下由n2摩尔溶质和n1摩尔溶剂所组成的二元体系,则积分溶解热的变化为:
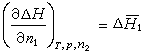
式中偏导,它是溶质2的微分溶解热;偏导,它是溶剂1的微分溶解热。
上式又可写为:
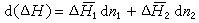
在物质溶解过程中,由于溶质和溶剂的本质及其相对含量的不同,有的吸热(如硝酸铵溶于水);有的放热(如硫酸加水稀释)。
物质的溶解热可用各种不同类型的量热器直接测量,测得的结果实际上是积分溶解热。根据不同浓度下的积分溶解热数值,可利用作图法求得微分溶解热。具体方法是以积分溶解热作纵坐标,溶质的摩尔数作横坐标,绘出热效应曲线,曲线上任一点的正切,便是该浓度下溶质的微分溶解热。