-
依诺沙星 编辑
药品名称:依诺沙星
外文名:eNOxacin
是否处方药:是
主要适用症:脓疱疮、毛囊炎、疖肿、烧烫伤创面感染及足癣合并细菌感染等各种皮肤软组织细菌性感染
主要用药禁忌:对本品及氟喹诺酮类药过敏、缺乏葡萄糖-6-磷酸脱氢酶的患者禁用
剂型:口服常释剂型(片剂、胶囊剂)、乳膏剂、外用液体剂(眼用制剂)、注射剂
批准文号:国药准字H10980230
药品类型:原料药
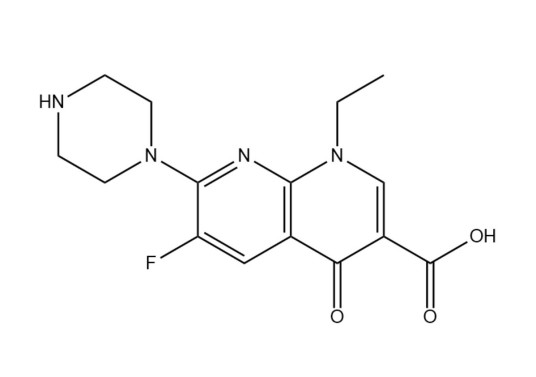
化学式:C15H17FN4O3
CAS登录号:74011-58-8
熔点:220至224℃
沸点:569.9℃
水溶性:几乎不溶
密度:1.388g/cm³
外观:白色至浅黄色结晶性粉末
闪点:298.4℃
安全性描述:S26;S36/37
危险性符号:Xi
危险性描述:R36/37/38
喹诺酮类抗菌药。
适用于脓疱疮、毛囊炎、疖肿、烧烫伤创面感染及足癣合并细菌感染等各种皮肤软组织细菌性感染的治疗。
一、片剂:口服:一次0.2~0.4g,一日2次,或遵医嘱。疗程4-14日。根据病情,用量和疗程可酌情增减。
二、胶囊:口服。成人常用量:
1、支气管感染:一次0.3~0.4g,一日2次,疗程7~14日。
2、急性单纯性下尿路感染:一次0.2g,一日2次,疗程5~7日;复杂性尿路感染:一次0.4g,一日2次,疗程10~14日。
4、肠道感染:一次0.2g,一日2次,疗程5~7日。
5、伤寒:一次0.4g,一日2次,疗程10~14日。
三、乳膏:外用。涂于患处,一日2~4次。
四、滴眼液:滴眼。一次1~2滴,一日4~6次。
一、片剂或胶囊:
1、胃肠道反应较为常见,可表现为腹部不适或疼痛、腹泻、恶心或呕吐。
3、过敏反应:皮疹、皮肤瘙痒,偶可发生渗出性多形性红斑及血管神经性水肿。少数患者有光敏反应。
4、偶可发生:
(3)静脉炎。
(4)结晶尿,多见于高剂量应用时。
(5)关节疼痛。
5、少数患者可发生血清氨基转移酶升高、血尿素氮增高及周围血象白细胞降低,多属轻度,并呈一过性。
二、乳膏:局部不良反应较少见。长期大量使用自皮肤吸收后也可能产生与全身用药相同的不良反应,如:皮疹、皮肤瘙痒等过敏反应,腹部不适、腹泻、恶心等胃肠道反应,头昏、头痛等中枢神经系统反应及血清氨基转移酶升高、血尿素氨增高及周围血象白细胞降低等其他反应。
三、滴眼液:少数患者可有轻微刺激感,不影响使用。
2、本品与茶碱类合用时可能由于与细胞色素P450结合部位的竞争性抑制,导致茶碱类的肝消除明显减少,血消除半衰期延长,血药浓度升高,出现茶碱中毒症状,如恶心、呕吐、震颤、不安、激动、抽搐、心悸等,应避免合用,不能避免时应测定茶碱类血药浓度并调整剂量。
3、环孢素与本品合用时,其血药浓度升高,必须监测环孢素血浓度,并调整剂量。
4、本品与抗凝药华法林合用时可增强后者的抗凝作用,故应避免二者合用。不能避免时应严密监测患者的凝血酶原时间,并调整剂量。
5、丙磺舒可减少本品自肾小管分泌约50%,合用时可因本品血浓度增高而产生毒性。
6、本品干扰咖啡因的代谢,从而导致咖啡因消除减少,血消除半衰期(t1/2β)延长,并可能产生中枢神经系统毒性,故应避免二者合用。不能避免时应严密监测患者咖啡因的血药浓度并调整剂量。
7、含铝、镁的制酸药可减少本品的口服吸收,不宜合用。
本品具广谱抗菌作用,尤其对需氧革兰阴性杆菌抗菌活性高,对下列细菌在体外具良好抗菌作用:肠杆菌科的大部分细菌,包括枸椽酸杆菌属、阴沟、产气肠杆菌等肠杆菌属、大肠埃希菌、克雷伯菌属、变形杆菌属、沙门菌属、志贺菌属、弧菌属、耶尔森菌等。常对多重耐药菌也具有抗菌活性。对青霉素耐药的淋病奈瑟菌、产酶流感嗜血杆菌和莫拉菌属均具有高度抗菌活性。对铜绿假单胞菌等假单胞菌属的大多数菌株具抗菌作用。本品对甲氧西林敏感葡萄球菌具抗菌活性,对肺炎链球菌、溶血性链球菌和粪肠球菌仅具中等抗菌活性。对沙眼衣原体、支原体、军团菌具良好抗微生物作用,对结核杆菌和非典型分枝杆菌也有抗菌活性。对厌氧菌的抗菌活性差。依诺沙星为杀菌剂,通过作用于细菌DNA螺旋酶的A亚单位,抑制DNA的合成和复制而导致细菌死亡。
据期临床试验资料及有关文献报导:本品口服吸收好,单次口服0.1g,血药峰浓度为3.06~3.22mg/L。本品口服吸收后,体内分布较广,血浆蛋白结合率为18-57%。消除半衰期为4.8小时,药物主要通过尿液及胆汁以原形排泄。单次给药后6~12小时尿中药物浓度仍可达117 mg/L,24小时内自尿中可排出给药量的55%。
1、与食物同服可能影响本品的口服吸收,宜空腹服用或进餐前至少1小时,餐后至少2小时服用本品。胃酸的减少也可能使本品的口服后吸收减少。
2、由于大肠埃希菌对氟喹诺酮类药物耐药者多见,应在给药前留取尿培养标本,参考细菌药敏结果调整用药。
3、本品大剂量应用或尿pH值在7以上时可发生结晶尿。为避免结晶尿的发生,宜多饮水,保持24小时排尿量在1200ml以上。
5、应用氟喹诺酮类药物可发生中、重度光敏反应。应用本品时应避免过度暴露于阳光,如发生光敏反应需停药。
6、肝功能减退时,如属重度(肝硬化腹水)可减少药物清除,血药浓度增高,肝、肾功能均减退者尤为明显,均需权衡利弊后应用,并调整剂量。
7、原有中枢神经系统疾患者,例如癫痫及癫痫病史者均应避免应用,有指征时需仔细权衡利弊后应用。
孕妇及哺乳期妇女用药
动物实验未证实喹诺酮类药物有致畸作用,但对孕妇用药进行的研究尚无明确结论。鉴于本药可引起未成年动物关节病变,故孕妇禁用,哺乳期妇女应用本品时应暂停哺乳。
儿童用药
本品在婴幼儿及18岁以下青少年的安全性尚未确定。但本品用于数种幼龄动物时,可致关节病变。因此不宜用于18岁以下的小儿及青少年。
老年患者用药
老年患者常有肾功能减退,因本品部分经肾排出,需减量应用。
遮光,密封,在干燥处保存。
基本信息
化学式:C15H17FN4O3
分子量:320.319
CAS号:74011-58-8
EINECS号:74011-58-8
理化性质
密度:1.388g/cm3
熔点:220-224°C
沸点:569.9℃
闪点:298.4℃
折射率:1.599
外观:白色至浅黄色结晶性粉末
溶解性:易溶于冰醋酸,微溶于甲醇,极微溶于氯仿或丙酮,几不溶于乙醇,乙醚或水
分子结构数据
摩尔折射率:78.79
摩尔体积(cm3/mol):230.6
等张比容(90.2K):636.7
表面张力(dyne/cm):58.0
极化率(10-24cm3):31.23
计算化学数据
疏水参数计算参考值(XlogP):无
氢键供体数量:2
氢键受体数量:8
可旋转化学键数量:3
互变异构体数量:0
拓扑分子极性表面积:85.8
重原子数量:23
表面电荷:0
复杂度:521
同位素原子数量:0
确定原子立构中心数量:0
不确定原子立构中心数量:0
确定化学键立构中心数量:0
不确定化学键立构中心数量:0
共价键单元数量:1
用途
依诺沙星为第三代喹诺酮类药物,体外抗菌谱和抗菌活性与氟哌酸相似。临床主要用于对其敏感的革兰阴性菌和阳性菌引起的感染,如泌尿、肠道、呼吸道、外科、眼科、妇产科、皮肤科及五官科等感染性疾病。
来源
本品为1-乙基-6-氟-1,4-二氢-4-氧代-7-(1-哌嗪基)-1,8-萘啶-3-羧酸倍半水合物,按干燥品计算,含依诺沙星(按C15H17FN4O3计)应为98.5%~102.0%。
鉴别
1、在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
2、本品的红外光吸收图谱应与对照的图谱(光谱集282图)一致。
检查
溶液的澄清度与颜色
取本品0.50g,加氢氧化钠试液10mL溶解后,溶液应澄清无色,如显浑浊,与1号浊度标准液(通则0902第一法)比较,不得更浓,如显色,与黄色或黄绿色4号标准比色液(通则0901第一法)比较,不得更深。
照高效液相色谱法(通则0512)测定。
供试品溶液:取本品约25mg,置100mL量瓶中,加0.1mol/L盐酸溶液约20mL使溶解,用流动相A稀释至刻度,摇匀。
对照溶液:精密量取供试品溶液1mL,置100mL量瓶中,用流动相A稀释至刻度,摇匀。
系统适用性溶液:取依诺沙星对照品、诺氟沙星杂质B对照品和氧氟沙星对照品适量,加0.1mol/L盐酸溶液溶解并稀释制成每1mL中约含依诺沙星(按C15H17FN4O3计)0.25mg、诺氟沙星杂质B2.5µg和氧氟沙星2.5µg的混合溶液。
色谱条件:用十八烷基硅烷键合硅胶为填充剂,以0.025mol/L磷酸溶液(用三乙胺调节pH值至3.0)-甲醇-乙腈(80:10:10)为流动相A,以0.025mol/L磷酸溶液(用三乙胺调节pH值至3.0)-甲醇-乙腈(350:325:325)为流动相B,按下表进行线性梯度洗脱,柱温为40℃,检测波长为269nm,进样体积20µL。
时间(分钟) | 流动相A(%) | 流动相B(%) |
0 | 100 | 0 |
10 | 100 | 0 |
25 | 0 | 100 |
35 | 0 | 100 |
36 | 100 | 0 |
45 | 100 | 0 |
系统适用性要求:系统适用性溶液色谱图中,依诺沙星峰的保留时间约为9分钟,诺氟沙星杂质B峰与依诺沙星峰 之间的分离度应大于4.9,依诺沙星峰与氧氟沙星峰之间的分离度应大于1.1。
测定法:精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图。
限度:供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积的0.3倍(0.3%),各杂质峰面积的和不得大于对照溶液主峰面积(1.0%),小于对照溶液主蜂面积0.05倍的峰忽略不计。
干燥失重
取本品,在105°C干燥至恒重,减失重量应为7.8%~9.0%(通则0831)。
炽灼残渣
取本品1.0g,置坩埚中,依法检查(通则0841),遗留残渣不得过0.1%。
取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
含量测定
照高效液相色谱法(通则0512)测定。
供试品溶液
取本品适量(约相当于依诺沙星,按C15H17FN4O3计 25mg),精密称定,置100mL量瓶中,加0.1mol/L盐酸溶液约20mL使溶解,用流动相稀释至刻度,摇匀,精密量取5mL,置25mL量瓶中,用流动相稀释至刻度,摇匀。
对照品溶液
取依诺沙星对照品约25mg,精密称定,制备方法同供试品溶液。
系统适用性溶液
取依诺沙星对照品5mg、诺氟沙星杂质B对照品和氧氟沙星对照品各2.5mg,置100mL量瓶中,加0.1mol/L盐酸溶液约4mL使溶解,用流动相稀释至刻度,摇匀。
色谱条件
用十八烷基硅烷键合硅胶为填充剂,以0.025mol/L磷酸溶液(用三乙胺调节pH值至3.0)-甲醇-乙腈(80:10:10)为流动相,检测波长为269nm,进样体积20μL。
系统适用性要求
系统适用性溶液色谱图中,依诺沙星峰的保留时间约为9分钟,诺氟沙星杂质B峰与依诺沙星峰之间的分离度应大于4.9,依诺沙星峰与氧氟沙星峰之间的分离度应大于1.1。
测定法
精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
1、依诺沙星片。(片剂)
2、依诺沙星乳膏。(乳膏剂)
3、依诺沙星胶囊。(胶囊剂)
4、依诺沙星滴眼液。(眼用制剂)
5、葡萄糖酸依诺沙星注射液。(注射剂)