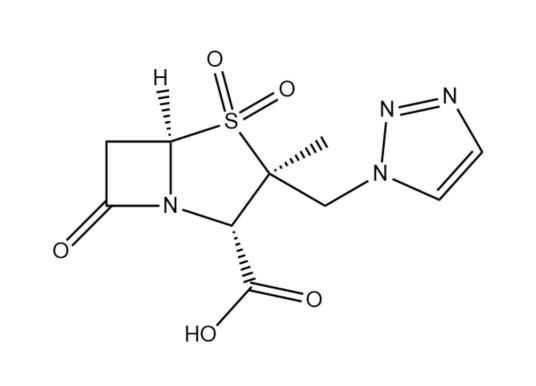
-
他唑巴坦 编辑
中文名:他唑巴坦
外文名:TazobaCTam
化学式:C10H12N4O5S
CAS登录号:89786-04-9
熔点:172℃
沸点:707.1℃
水溶性:几乎不溶
密度:1.92g/cm³
外观:白色结晶性粉末
闪点:381.4℃
安全性描述:S26;S36/37/39;S45
危险性符号:Xi
危险性描述:R36/37/38
基本信息
化学式:C10H12N4O5S
分子量:300.291
CAS号:89786-04-9
理化性质
密度:1.92 g/cm3
沸点:707.1ºC
闪点:381.4ºC
折射率:1.818
外观:白色结晶性粉末
分子结构数据
摩尔折射率:49.42
摩尔体积(cm3/mol):143.4
等张比容(90.2K):416.9
表面张力(dyne/cm):71.3
极化率(10-24cm3):19.59
计算化学数据
疏水参数计算参考值(XlogP):-2
氢键供体数量:1
可旋转化学键数量:3
互变异构体数量:2
拓扑分子极性表面积:131
重原子数量:20
表面电荷:0
复杂度:573
同位素原子数量:0
确定原子立构中心数量:3
不确定原子立构中心数量:0
确定化学键立构中心数量:0
不确定化学键立构中心数量:0
共价键单元数量:1
用途
他唑巴坦为β-内酰胺酶抑制剂,第三代抗菌强增效剂,与哌拉西林或头孢哌酮合用可增强二者的药效及延长作用时间。他唑巴坦钠与哌拉西林钠联合使用时,产生明显的协同作用,广泛用于治疗严重全身性和局部感染、腹腔感染、下呼吸道感染、软组织感染、败血症等,比已使用的其他抗菌复合剂具有更广泛的抗菌谱及适应症,克服耐药性显示了巨大优势。
基本信息
本品为(2S,3S,5R)-3-甲基-7-氧代-3-(1H-1,2,3-三氮唑-1-基甲基)-4-硫杂-1-氮杂双环庚烷-2-羧酸4,4-二氧化物,按无水物计算,含他唑巴坦(C10H12N4O5S)应为98.0%~102.0%。
性状
本品为白色或类白色粉末或结晶性粉末,无臭,略有引湿性。
本品在N,N-二甲基甲酰胺中易溶,在甲醇或丙酮中微溶,在乙醇或水中微溶或极微溶解。
比旋度
取本品,精密称定,加甲醇-水(1:1)溶解并定量稀释制成每1mL中约含10mg的溶液,依法测定(通则0621),比旋度为+127°至+139°。
鉴别
1、在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
2、本品的红外光吸收图谱应与对照品的图谱(光谱集1260图)一致。
检查
酸度
取本品,加水制成每1mL中含2.5mg的溶液,超声使溶解,依法测定(通则0631),pH值应为2.0~2.5。
溶液的澄清度与颜色
取本品5份,分别加5%碳酸氢钠溶液溶解并稀释制成每1mL中含0.1g的溶液,溶液应澄清无色,如显浑浊,与1号浊度标准液(通则0902第一法)比较,均不得更浓,如显色,与黄色或黄绿色4号标准比色液(通则0901第一法)比较,均不得更深。
照高效液相色谱法(通则0512)测定。
供试品溶液:取本品适量,加流动相溶解并稀释制成每1mL中约含5mg的溶液。
对照溶液:精密量取供试品溶液1mL,置100mL量瓶中,用流动相稀释至刻度,摇匀。
系统适用性溶液:取他唑巴坦对照品约25mg,置25mL量瓶中,加0.01mol/L氢氧化钠溶液10mL,30°C放置30分钟,用0.01mol/L盐酸溶液中和,加流动相至刻度,摇匀,用磷酸调节pH值至4.0。
色谱条件:用十八烷基硅烷键合硅胶为填充剂,以乙腈-0.03mol/L磷酸二氢钾溶液-10%四丁基氢氧化铵溶液(190:795:15)(用磷酸调节pH值至4.0)为流动相,检测波长为230nm,进样体积20µL。
系统适用性要求:系统适用性溶液色谱图中,他唑巴坦峰拖尾因子应不大于1.5,他唑巴坦峰与最大杂质峰之间的分离度应不小于10,他唑巴坦峰与相邻杂质峰之间、最大杂质峰与相邻杂质峰之间的分离度均应符合要求。
测定法:精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
限度:供试品溶液色谱图中如有杂质峰,单个杂质蜂面积不得大于对照溶液主峰面积(1.0%),各杂质峰面积的和不得大于对照溶液主峰面积的1.5倍(1.5%)。
残留溶剂
照残留溶剂测定法(通则0861第二法)测定。
供试品溶液:取本品约0.1g,精密称定,置顶空瓶中,精密加入N,N-二甲基甲酰胺2mL使溶解,密封。
对照品溶液:精密称取二氯甲烷约15mg,丙酮、乙醇、乙酸乙酯和甲基异丁基酮各约0.125g,置同一50mL量瓶中,加N,N-二甲基甲酰胺稀释至刻度,摇匀,再精密量取5mL,置50mL量瓶中,用N,N-二甲基甲酰胺稀释至刻度,摇匀,精密量取2mL,置顶空瓶中,密封。
色谱条件:以100%二甲基聚硅氧烷(或极性相近)为固定液的毛细管柱为色谱柱,起始温度为40°C,维持10分钟,再以每分钟40°C的速率升温至100°C,维待1分钟,进样口温度为200℃,检测器温度为250°C,顶空瓶平衡温度为50°C,平衡时间为30分钟。
系统适用性要求:对照品溶液色谱图中,各成分峰之间的分离度均应符合要求。
测定法:取供试品溶液与对照品溶液分别顶空进样,记录色谱图。
限度:按外标法以峰面积计算,二氯甲烷、丙酮、乙醇、乙酸乙酯和甲基异丁基酮的残留量均应符合规定。
水分
取本品,照水分测定法(通则0832第一法1)测定,含水分不得过1.0%。
炽灼残渣
取本品1.0g,依法检查(通则0841),遗留残渣不得过0.1%。
取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之二十。
含量测定
照高效液相色谱法(通则0512)测定。
供试品溶液
取本品适量,精密称定,加流动相溶解并定量稀释制成每1mL中约含1mg的溶液。
对照品溶液
取他唑巴坦对照品适量,精密称定,加流动相溶解并定量稀释制成每1mL中约含1mg的溶液。
系统适用性溶液、色谱条件与系统适用性要求
见有关物质项下。
测定法
精密量取供试品溶液与对照品溶液,分别注入液相色谱仪,记录色谱图。按外标法以峰面积计算。
类别
β-内酰胺酶抑制药。
贮藏
密闭,阴凉干燥处保存。
适应症
适用于对本品敏感的葡萄球菌属、大肠菌属、枸缘酸菌属、克雷伯氏菌属、肠杆菌属、普罗韦德斯菌属、绿脓菌属引起的败血症、复杂性膀胱炎、肾盂肾炎。
用量
静脉推注时,溶于灭菌注射用水、氯化钠注射液或葡萄糖注射液中,缓慢注射。静脉滴注时不使用灭菌注射用水,可使用0.9%氯化钠注射液或5%葡萄糖溶液。
成人每天用量为2.5-5.0g,分2次静脉推注或静脉滴注。儿童每天60-150mg/kg,分3-4次静脉推注或静脉滴注。成人每天用药量不超过5.0g。
肾功能不全患者,需要在用药量、用药间隔等方面适当调节,谨慎用药;例如成人从1.25g开始用药。
不良反应
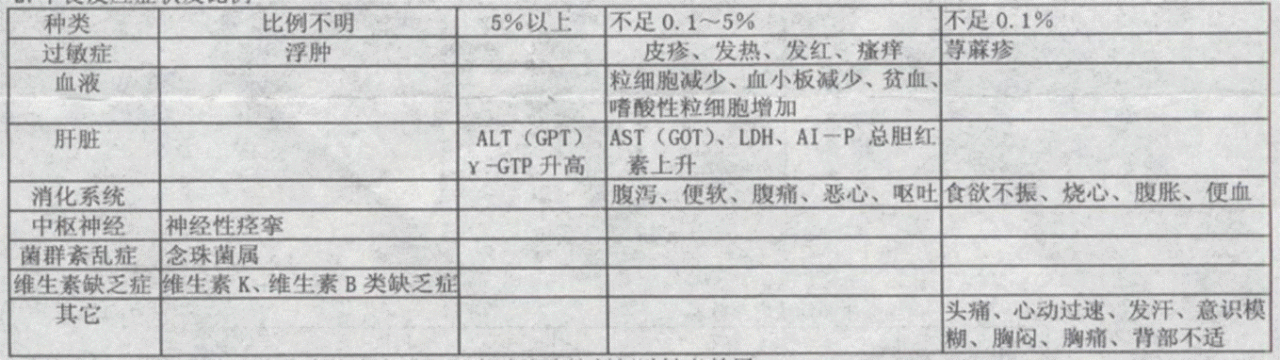
1、本品常见不良反应有:
(1)皮肤反应:皮疹、类过敏症状(呼吸困难、哮喘样发作、皮肤瘙痒等),要予以充分监测,发现异常时终止用药,进行适当处理。
(2)中毒性表皮坏死症、皮肤黏膜眼症状群:中毒性表皮坏死症、皮肤黏膜眼症状群,要随时监测,发现异常时终止用药,进行适当处理。
(3)急性肝炎、肝功能坏死、黄疸:有时出现急性肝炎、天冬门氨基酸转移酶、丙氨酸氨基转移酶升高等引起的肝功能损伤、黄疸,因此要定期检查,用药期间应定期监测,发现异常时终止用药,进行适当处理。
(4)急性肾功能不全,间质性肾炎:有时出现急性肾功能不全,间质性肾炎等严重肾功能障碍,因此要定期进行充分观察,给与充分注意,发现异常时终止用药,进行适当处理。
(5)全血球减少,无颗粒细胞症、血小板减少症、溶血性贫血:有时候出现全血球减少,无颗粒细胞症、血小板减少症、溶血性贫血(初期症状:发热、咽喉疼痛、皮下或黏膜出血、贫血、黄疸等),用药期间应定期监测,发现异常时终止用药,进行适当处理。
(6)伪膜性肠炎:有时出现伴有便血的假膜性肠炎等严重大肠炎,当有腹泻、腹痛时应立即终止用药,进行适当处理。
(7)间质性肺炎、PIE症状群:有时出现间质性肺炎(不足0.1%)、PIE症状群(出去症状:咳嗽、呼吸困难、胸部X射线异常、嗜酸性粒细胞增多等),当发现这些症状时,应终止用药,并用副肾皮质激素等进行适当处理。
(8)横纹肌溶解症:有时出现伴随剧烈肾功能恶化的横纹肌溶解症,所以在出现肌肉疼痛、乏力、CK(CPK)值上升及血尿中血红蛋白上升时应终止用药,进行适当处理。
(9)此外,本品尚可见下列不良反应:维生素K缺乏症(低凝血酶原血症状、初学倾向等),维生素B类缺乏症状(舍类、口腔炎、食欲不振、神经炎等)。
2、不良反应症状及比例
禁忌
注意事项
1、在使用本品前,应询问患者对青霉素类药物,头孢类药物、β-内酰胺酶抑制剂有无过敏史,并进行皮肤敏感试验,呈阳性者禁用;
2、对口服摄取不良的患者或非经口服营养的患者、全身病情恶化的患者、因不能通过饮食摄取维生素K,担心有维生素K缺乏症,所以要充分进行观察。
3、有出血因素的患者,使用本品有增加出血的可能,应予以注意。
6、使用时的注意事项:
(1)溶解后立即使用。
(2)本品与氨基糖苷类抗生素(妥布拉霉素)合用时会使氨基糖苷类抗生素活性降低,所以本品和氨基糖苷抗生素配伍使用时,要使用分别给药的方法。
(3)因为本品和下列输液配伍时,3小时后效价明显降低,所以应避免与其配伍:强力MoriaminS(一种高浓度氨基酸制剂)、MoripronF(谷氨酸、赖氨酸烟酰胺、维生素B2、B6的复合制剂)、木糖醇制剂。
(4)本品和呋氟脲嘧啶、维生素C注射液配伍时,3小时后效价明显降低,所以配好后应立即使用。
(5)本品与下列制剂配伍后在6-24小时出现结晶现象,因此配伍后应立即使用。配伍试剂:潘生丁注射液、Neolamin(二硫硫胺·维生素B2复合制剂)、注射用Vitaneurin(维生素B12、呋喃硫胺、维生素B2、B6的复合制剂)、注射用头孢拉宗、注射用头孢磺啶、注射用米诺环素。
7、对临床检查结果的影响:
(1)使用本品期间用尿糖试药丸、班氏试剂、斐林试剂等还原试剂测定尿糖时易出现假阳性,要加以注意。
(2)有时会出现直接抗球蛋白试验阳性,要加以注意。
(3)本品用于侵袭性曲霉病诊断的血清中曲霉原半乳甘露聚糖的检查中有时呈假阳性,要加以注意。
8、其他注意事项:
(2)有与becronium(肌迟缓药)并用时引起肌迟缓作用延长的报导。
孕妇及哺乳期妇女用药
1、尚未确定妊娠期间用药的安全性,因此孕妇及计划怀孕者慎用。
2、动物(大鼠)实验表明本品在乳汁中有排泄,因此哺乳期妇女用药时应暂停哺乳。
儿童用药
1、低体重出生儿、新生儿用药的安全性尚不清楚。
2、婴幼儿(特别是不足一周岁)易发生下痢、便软,要慎重用药。
老年用药
1、老年患者一般生理功能下降,多易出现副作用,要充分观察,用药量从1.25g开始谨慎用药。
2、老年患者容易因维生素K缺乏引起出血倾向。
药物相互作用

药物过量
药理毒理
本品为半合成青霉素类抗生素,通过抑制细菌细胞壁合成而起抗菌作用,他唑巴坦为β-内酰胺酶抑制药,对β-内酰胺酶、青霉素酶、头孢菌素酶及氯亚胺头孢菌素酶(Ⅰ型)有抑制作用。本品对革兰阳性菌、革兰阴性菌和厌氧菌有抗菌作用;对产β-内酰胺酶和对哌拉西林的耐药菌有抑制作用。
药代动力学
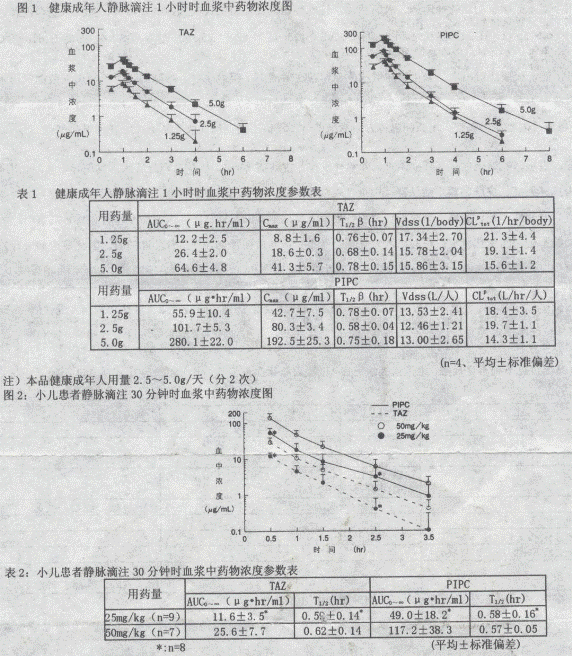
1、血浆中浓度
健康成年人静脉滴注1小时时,血浆中药物浓度的变化及药理学参数如图1和表1所示,他哆巴坦(TAZ)、哌拉西林(PIPC)在血浆中浓度随用量的增加而上升。儿童静脉滴注30分钟后的血消除半衰期同健康人一样(图2和表2)。
2、组织内分布
肺、肾、女性生殖器等器官中分布。
3、代谢
在人的血浆、尿中有非活性代谢产物2-氨基-3-甲基-3-亚磺基-4, -(1H-1,2,3-三唑-1-甲基)酪酸(M-1)及哌拉西林的活性代谢物:哌拉西林的脱乙基产物(DEt-PIPC)。
4、排泄
健康成年人静脉注射本品2.5g,在24小时内肾排泄率为TAZ:70.8%、M-1:19.4%、PIPC:69.3%、DEt-PIPC:4.5%。小儿患者在用药6小时内肾排泄率TAZ:43.3~56.9%、PIPC:39.9~56.4%。
5、肾功能不全患者的药代动力学
肾功能不全的患者,随着肾功能的下降,哌拉西林、他唑巴坦的半衰期减慢及AUC0~∞增加程度变大,所以,肾功能不全的患者在使用本品时,应按肾功能损伤程度减少用药量或延长用药时间。
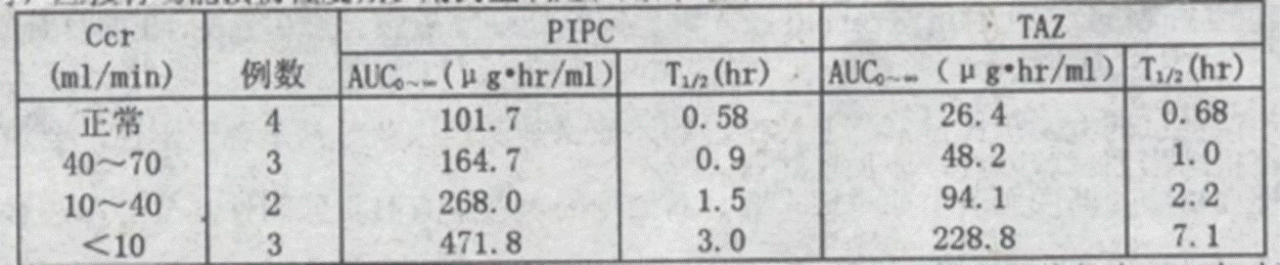
对于Ccr不到10ml/min的患者,通过血液透析,使哌拉西林、他唑巴坦的半衰期分别恢复为1.5小时和1.7小时。
安全术语
S26:In case of contact with eyes, rinse immediately with plenty of water and seek medical advice.
眼睛接触后,立即用大量水冲洗并征求医生意见。
S36/37/39:Wear suitable protECTive clothing, gloves and eye/face protection.
穿戴适当的防护服、手套和眼睛/面保护。
S45:In case of accident or if you feel unwell, seek medical advice immediately (show the lable where possible).
发生事故时或感觉不适时,立即求医(可能时出示标签)。
风险术语
R36/37/38:Irritating to eyes, respiratory system and skin.
刺激眼睛、呼吸系统和皮肤。