-
β-内酰胺酶 编辑
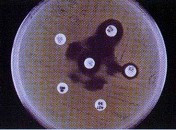
第一个报道的金属酶是从蜡样芽孢杆菌( Bacill us cereus) 中发现的,该酶为锌依赖酶。20 世纪80 年代初期日本从嗜麦芽窄食单胞菌中鉴定出第二种锌依赖青霉素酶L1 型酶,随后又从嗜水气单胞菌和脆弱拟杆菌中鉴定出多种能水解亚胺培南的金属酶。这些酶都由染色体基因编码。该类金属酶分布在蜡样芽孢杆菌、嗜麦芽窄食单胞菌、脆弱拟杆菌、气单胞菌属和戈氏军团菌中,除嗜麦芽窄食单胞菌外,在临床上都极为罕见,而且都是单株散发的。
1991 年日本学者在铜绿假单胞菌中发现了第一种质粒介导的金属酶( IMP21) ,不久又从脆弱拟杆菌中发现了一种可转移金属酶,这两个酶的发现意味着金属酶已经从单株散发向随机分布过渡。现在已报道了10多种可转移金属酶: IMP21~8 和VIM21~3,分布在铜绿假单胞菌、不动杆菌和肠杆菌科细菌中,地域分布上已经不再局限于日本,现已分布至亚洲、欧洲和美洲的多个国家。
各种β-内酰胺类抗生素的作用机制均相似,都能抑制胞壁粘肽合成酶,即青霉素结合蛋白从而阻碍细胞壁粘肽合成,使细菌胞壁缺损,菌体膨胀裂解(胞壁粘肽合成过程见三十七章)。除此之外,对细菌的致死效应还应包括触发细菌的自溶酶活性,缺乏自溶酶的突变株则表现出耐药性。哺乳动物无细胞壁,不受β-内酰胺类药物的影响,因而本类药具有对细菌的选择性杀菌作用,对宿主毒性小。近十多年来已证实细菌胞浆膜上特殊蛋白PBPs是β-内酰胺类药的作用靶位,PBPs的功能及与抗生素结合情况归纳于。各种细菌细胞膜上的PBPs数目、分子量、对β-内酰胺类抗生素的敏感性不同,但分类学上相近的细菌,其PBPs类型及生理功能则相似。例如大肠杆菌有7种PBPs,PBP1A,PBP1B与细菌延长有关,青霉素、氨苄西林、头孢噻吩等与PBP1A、PBP1B有高度亲和力,可使细菌生长繁殖和延伸受抑制,并溶解死亡,PBP2与细管形状有关,美西林、棒酸与硫霉素(亚胺培南)能选择性地与其结合,使细菌形成大圆形细胞,对渗透压稳定,可继续生几代后才溶解死亡。PBP3功能与PBP1A相同,但量少,与中隔形成,细菌分裂有关,多数青霉素类或头孢菌素类抗生素主要与PBP1和(或)PBP3结合,形成丝状体和球形体,使细菌发生变形萎缩,逐渐溶解死亡。PBP1,2,3是细菌存活、生长繁殖所必需,PBP4,5,6;与羧肽酶活性有关,对细菌生存繁殖无重要性,抗生素与之结合后,对细菌无影响。
β-内酰胺酶可能添加的食品:乳制品,特别是“无抗奶”。β-内酰胺酶类物质被用作牛奶中抗生素的分解剂。
解读β-内酰胺酶:不得不先说说β-内酰胺类抗生素。β-内酰胺类抗生素是在牛乳生产中应用最广泛的抗生素,用于治疗牛乳腺炎和其他细菌感染性疾病。按照国家规定,使用抗生素药物后一定时间内的乳汁,不得作为供人食用的原料。同时国家在《生鲜牛乳收购标准》中规定,生鲜乳中不得检出抗生素。然而就中国奶牛饲养环境而言,牛奶的绝对“无抗”较难达到,针对这种情况,市场上出现了“抗生素分解剂”,该分解剂可选择性分解牛奶中残留的β-内酰胺抗生素,其成分就是β-内酰胺酶。
β-内酰胺酶(金玉兰酶制剂),可能添加到乳与乳制品中,起到掩蔽抗生素的作用,但是由于该制剂的安全性风险未知,因此所有乳制品生产企业严禁在产品中添加此类物质。