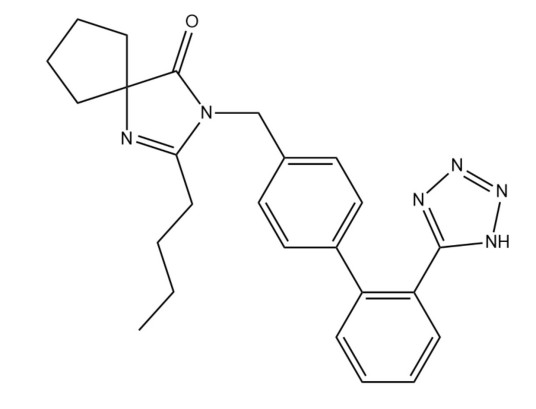
-
厄贝沙坦 编辑
中文名:厄贝沙坦
外文名:irbesartan
别名:2-丁基-3-苄基]-1,3-二氮杂螺-壬-1-烯-4-酮
化学式:C25H28N6O
CAS登录号:138402-11-6
EINECS登录号:604-078-2
熔点:180至181℃
沸点:648.6℃
密度:1.3g/cm³
外观:白色结晶性粉末
闪点:346℃
安全性描述:S26;S36/37/39
危险性符号:Xn
危险性描述:R22
UN危险货物编号:3276
是否处方药:是
基本信息
化学式:C25H28N6O
分子量:428.53
CAS号:138402-11-6
EINECS号:604-078-2
理化性质
熔点:180-181℃
沸点:648.6℃
密度:1.3g/cm3
闪点:346℃
logP:4.51
折射率:1.690
外观:白色结晶性粉末
分子结构数据
摩尔折射率:125.44
摩尔体积(cm3/mol):328.2
等张比容(90.2K):891.5
表面张力(dyne/cm):54.4
极化率(10-24cm3):49.73
计算化学数据
氢键供体数量:1
可旋转化学键数量:7
互变异构体数量:2
拓扑分子极性表面积:87.1
重原子数量:32
表面电荷:0
复杂度:682
同位素原子数量:0
确定原子立构中心数量:0
不确定原子立构中心数量:0
确定化学键立构中心数量:0
不确定化学键立构中心数量:0
共价键单元数量:1
适应症
用法用量
通常建议的初始剂量和维持剂量为每日150mg,饮食对服药无影响。一般情况下,厄贝沙坦150mg每天一次比75mg能更好地控制24小时的血压。但对某些特殊的病人,特别是进行血液透析和年龄超过75岁的病人,初始剂量可考虑用75mg。使用厄贝沙坦150mg每天一次不能有效控制血压的患者,可将本品剂量增至300mg,或者增加其他抗高血压药物。尤其是加用利尿剂如氢氯噻嗪已经显示出具有附加效应。在患有2型糖尿病的高血压患者中,治疗初始剂量应为150mg每日一次,并增量至300mg每日一次,作为治疗肾病较好的维持剂量。临床研究证明,厄贝沙坦使高血压2型糖尿病患者的肾脏受益。在研究中,厄贝沙坦在必要时加用其他抗高血压药物,降低患者血压并达到目标值。
肾功能损伤:肾功能损伤的患者无需调整本品剂量,但对进行血液透析的病人,初始剂量可考虑使用低剂量(75mg)。
肝功能损害:轻中度肝功能损害的患者无需调整本品剂量。对严重肝功能损害的病人,无临床经验。
老年患者:尽管75岁以上的老年人可考虑由75mg作为起始剂量,但通常对老年患者不需调整剂量。
儿童:安博维在儿童的安全性和疗效尚未建立。
药理毒理
本品为血管紧张素Ⅱ(AngiotensinⅡ,AngⅡ)受体抑制剂,能抑制AngⅠ转化为AngⅡ,能特异性地拮抗血管紧张素转换酶1受体(AT1),对AT1的拮抗作用大于AT28500倍,通过选择性地阻断AngⅡ与AT1受体的结合,抑制血管收缩和醛固酮的释放,产生降压作用。本品不抑制血管紧张素转换酶(ACE)、肾素、其它激素受体,也不抑制与血压调节和钠平衡有关的离子通道。
药代动力学
口服给药后,厄贝沙坦吸收良好;其绝对生物利用度为60%~80%,进食不会明显影响其生物利用度。血浆达峰时间为1~1.5小时,消除半衰期为11~15小时。三天内达稳态。厄贝沙坦通过葡萄糖醛酸化或氧化代谢,体外研究表明主要由细胞色素酶P450 2C9氧化。本品及代谢物经胆道和肾脏排泄。厄贝沙坦的血浆蛋白结合率约为90%。厄贝沙坦的药代动力学在10-600mg范围内显示线性和剂量相关性。
不良反应
常见不良反应为:头痛、眩晕、心悸等,偶有咳嗽,一般程度都是轻微的,呈一过性,多数患者继续服药都能耐受。罕有荨麻疹及血管神经性水肿发生。文献报道本品不良反应发生率大于1%的有:消化不良、胃灼热感、腹泻、骨骼肌疼痛、疲劳和上呼吸道感染,但与空白对照组比没有显著性差异。大于1%但低于对照组发生率的有腹痛、焦虑、神经质、胸痛、咽炎、恶心呕吐、皮疹、心动过速等。低血压和直立性低血压发生率约为0.4%。
禁忌
注意事项
1、血容量不足患者:对于服用强效利尿剂,饮食中严格限盐以及腹泻呕吐而使血容量不足的患者,在服用本品时可能会发生症状性低血压,特别是在首剂服用后。在开始服用本品之前应纠正这些情况。
2、肾血管性高血压:存在双侧肾动脉狭窄或单个功能的动脉发生狭窄的患者,使用影响肾素—血管紧张素—醛固酮系统的药物时,发生严重低血压和肾功能不全的危险增加。尽管本品的研究中没有发现这种情况,但使用时应考虑血管紧张素II受体拮抗剂的类似效应。
3、肾功能损害和肾脏移植:当肾功能损害的患者使用本品时,推荐对血清钾和肌酣定期监测。没有关于近期移植患者使用本品的经验。
4、合并有2型糖尿病和肾脏疾病的高血压患者:在所有的亚组中,对晚期肾脏疾病患者研究结果进行分析显示厄贝沙坦对肾脏和心血管事件的效应是不一致的。尤其是本品似乎对妇女和非白种人群受益较少。
5、高钾血症:就如其它影响肾素—醛固酮系统的药物,使用本品过程中可能会发生高血钾,尤其是存在肾功能损害,由于糖尿病肾损害所致的明显蛋白尿或心力衰竭,建议密切监测这些患者的血清钾水平。
6、主动脉和二尖瓣狭窄,肥厚梗阻性心肌病:就如使用其它的血管扩张剂,主动脉和二尖瓣狭窄及肥厚性心肌病患者使用本品时应谨慎。
7、原发性醛固酮增多症:原发性醛固酮增多症的患者通常对那些通过抑制肾素—血管紧张素系统的抗高血压药物没有反应,因此不推荐这类患者使用本品。
孕妇及哺乳期妇女用药
作为保险措施,在妊娠的前三个月最好不使用本品。在计划妊娠前应转换为合适的替代治疗。在妊娠的第4个月至第9个月,直接作用于肾素—血管紧张素系统的物质能引起胎儿和新生儿的肾功能衰竭,胎儿头颅发育不良和胎儿死亡,因此,本品禁用于妊娠4月至9月的孕妇,应尽快停用本品,如果由于疏忽治疗了较长时间,应超声检查头颅和肾功能。泌乳:本品禁用于哺乳期。厄贝沙坦是否分泌入人乳汁尚不清楚。厄贝沙坦能分泌入鼠的乳汁中。
儿童用药
在儿童的安全性和疗效尚未建立。
药物过量
成人本品剂量达900mg/日,连续8周给药没有显示毒性。厄贝沙坦过量最可能的表现为低血压和心动过速;也会发生心动过缓。本品过量的治疗无相关的特殊资料。应对患者严密监测,治疗应该是对症和支持性的,建议的措施包括催吐和/或洗胃。活性炭对药物过量治疗有用。血液透析不能清除厄贝沙坦。
基本信息
本品为 2-丁基-3-苯甲基]-1,3-二氮杂螺壬-1-烯-4-酮,按干燥品计算,含C25H28N6O不得少于 99.0% 。
生产要求
应对生产工艺等进行评估以确定形成遗传毒性杂质N,N-二甲基亚硝胺和N,N-二乙基亚硝胺等的可能性。必要时,应采用适宜的分析方法对产品进行分析,以确认N,N-二甲基亚硝胺和N,N-二乙基亚硝胺等的含量符合我国药品监管部门相关指导原则或ICH M7指导原则的要求。
性状
本品为白色或类白色粉末或结晶性粉末。
鉴别
1、取本品与厄贝沙坦对照品适量,加流动相溶解并稀释制成每1mL中各约含50µg的溶液。照有关物质项下的方法试验,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致 。
2、本品的红外光吸收图谱应与对照的图谱(光谱集912图)一致。
检查
氯化物
取本品1.25g,加水100mL,超声,滤过,取续滤液40mL,依法检查(通则0801),与标准氯化钠溶液3.0mL制成的对照液比较,不得更浓(0.006%)。
硫酸盐
取本品1.0g,加水50mL,超声,滤过,取续滤液25mL,依法检查(通则0802),与标准硫酸钾溶液1.0mL制成的对照液比较,不得更浓(0.020%)。
取本品1.0g,依法检查(通则0806第一法),应符合规定。
有关物质
照高效液相色谱法(通则0512)测定。
供试品溶液:取本品,精密称定,加甲醇溶解并定量稀释制成每1mL中约含1mg的溶液。
对照溶液:精密量取供试品溶液1mL,置200mL量瓶中,用甲醇稀释至刻度,摇匀。
对照品溶液:取杂质I对照品,精密称定,加甲醇溶解 定量稀释制成每1mL中约含1.5µg的溶液。
系统适用性溶液:取厄贝沙坦对照品与杂质I对照品各适量,加甲醇溶解并稀释制成每1mL中各约含0.1mg的混合 溶液。
色谱条件:用十八烷基硅烷键合硅胶为填充剂,以磷酸溶液(取85%磷酸5.5mL,加水至950mL,用三乙胺调节pH值至3.2)-乙腈(62:38)为流动相,检测波长为220nm,进样体积10µL。
系统适用性要求:系统适用性溶液色谱图中,出峰顺序依次为杂质I峰、厄贝沙坦峰,杂质I峰与厄贝沙坦峰的分离度应大于2.0,理论板数按厄贝沙坦峰计算不低于2000。
测定法:精密量取供试品溶液、对照溶液与对照品溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的3倍。
限度:供试品溶液的色谱图中,如有与杂质I峰保留时间一致的色谱峰,按外标法以峰面积计算,不得过0.15%,其他单个杂质峰面积不得大于对照溶液主峰面积的0.2倍(0.1%),杂质总量不得过0.2%。
叠氮化物
照离子色谱法(通则0513)测定。
供试品溶液:取本品,精密称定,加90%甲醇溶液溶解并定量稀释制成每1mL中约含20mg的溶液。
对照品溶液:取叠氮化钠对照品,精密称定,加90%甲醇溶液溶解并定量稀释制成每1mL中约含叠氮化钠0.312µg的溶液。
系统适用性溶液:取溴化钾、叠氮化钠和硝酸钾各适量,加90%甲醇溶液溶解并稀释制成每1mL中各约含0.2µg的混合溶液。
色谱条件:用阴离子交换色谱柱(IonPac AS18柱,或效能相当的色谱柱),检测器为电导检测器,检测方式为抑制电导检测,柱温30'C,以氢氧化钾溶液为淋洗液,按下表程序进行分析柱浓度梯度洗脱,流速为每分钟1.0mL,用阀切换在线基体消除法对供试品溶液进样后在线处理,进样体积200μL。
时间(分钟) | 淋洗液浓度(mol/L) |
0~15 | 9×10-3 |
15~22 | 40×10-3 |
22~30 | 9×10-3 |
系统适用性要求:系统适用性溶液色谱图中,叠氮根与溴离子及硝酸根的分离度应大于1.5。
测定法:精密量取供试品溶液与对照品溶液,分别注入离子色谱仪,记录色谱图。
限度:供试品溶液色谱图中如显叠氮化物峰,按外标法以峰面积计算,不得过0.001%。
干燥失重
取本品,在105℃干燥至恒重,减失重量不得过0.5%(通则0831)。
炽灼残渣
取本品1.0g,依法检查,遗留残渣不得过0.1%(通则0841)。
取炽灼残渣项下遗留的残渣,依法检查(通则0821第二法),含重金属不得过百万分之十。
含量测定
取本品0.3g,精密称定,加冰醋酸20mL溶解后,加结晶紫指示剂1滴,用高氯酸滴定液(0.1mol/L)滴定至溶液显蓝色,并将滴定结果用空白试验校正。每1mL的高氯酸滴定液(0.1mol/L)相当于42.85mg的C25H28N6O。
类别
抗高血压药。
制剂
1、厄贝沙坦片。
2、厄贝沙坦分散片。
3、厄贝沙坦胶囊。
贮藏
密封保存。