-
雄激素受体 编辑
雄激素中最主要的形式为睾酮,雄激素在体内起着重要的作用。除了与生殖相关外,还具有保持体内激素平衡;刺激蛋白质合成代谢,促进氮沉积和增加肌纤维的数量和厚度等。通过对青春期前的猪(体重约为15kg)和青春期的猪(体重约为74kg)分组试验,结果表明公猪的饲料报酬率比去势公猪高20%,用睾酮或二氢睾酮处理的去势公猪,蛋白质合成率显着高于对照去势公猪,蛋白质降解率显着低于对照去势公猪(Mulvaney,1984)。James T等(1992)通过用去甲雄三烯醇酮乙酸盐处理小公牛,结果发现经处理的小公牛平均日增重高于对照小公牛(P<O.001)。Tarocco C等(1986)对63头大白公猪从30到130kg活重进行表型检测发现血液中睾酮浓度与背膘呈显着相关。然而雄激素是通过与雄激素受体(Androgen Receptor-AR)结合而发挥其功能的,若无雄激素受体,则雄激素对组织无刺激反应(refraCTory)。雄激素受体是雄激素作用的中介物质。许多年来欧美一些国家一直在研究雄激素受体基因。
雄激素受体是雄激素作用的中介物质
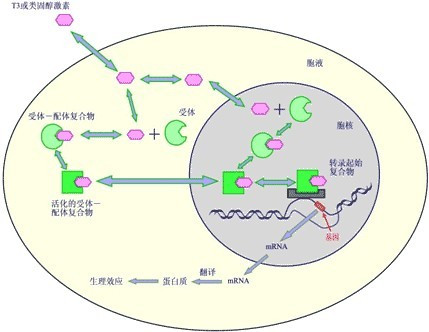
雄激素受体为分子量120000道尔顿的蛋白质,在人体的X染色体的基因指导下合成,与雄激素结合的单聚体(4.4S)在细胞中与受体蛋白及一个产生9S无活性的小分子单聚体结合。睾酮在体内代谢为双氢睾酮后才能与受体接近碳氧端位置结合,激活受体复合物并使其能够与细胞核的DNA受体位点结合,此位点被称为激素效应元件(hormone response element,HRE)或雄激素受体互补核糖核酸。
雄激素与受体结合部位主要在细胞核
受体活化中,包括大分子复合物的解聚,释放出附属蛋白质,其在DNA结合位置上与4.4S受体结合。此蛋白质区域中有丰富的胱氨酸,并与其他类固醇受体的结合区域具有高度的同族性。受体蛋白的另一区域能活化信息核糖核酸mRNA的转录,指导特异蛋白质的合成及细胞的生长和分化。雄激素与受体结合的部位主要在细胞核。
AR的作用机理与代谢
激素的作用过程很复杂。激素的类固醇通过血液循环到达靶细胞,在那里主要与清蛋白、更多地与特异的运载蛋白(如皮质类固醇结合球蛋白和性激素结合球蛋白)邻接,然后穿过细胞膜与胞液中高特异性受体蛋白相邻接,携带类固醇的激素受体(类固醇受体)与细胞核中的染色质发生复杂的相互作用,从而实现激素对靶细胞的调控。
雄激素要与胞液中的AR相结合才能发挥作用。而AR与雄激素相互作用的同时也伴随着AR生理功能的发挥和结构的变化:核转运、转录、磷酸化更新。Jorge A Simental等(1991)通过研究感染Cos CELLs发现雄激素依靠AR转运到核,然后与核中的染色质发生作用。Jacoba H Vawluan等(1991)用10nM的甲雄三烯醇酮(R1881)处理人类前列腺肿瘤细胞发现雄激素受体磷酸化增加1.8倍。此外,核中可提取的雄激素受体的量也增加,在获得与核紧密结合能力的同时伴随着激素诱导受体磷酸化;但是雄激素受体的磷酸化不依赖于激素,在无激素时雄激素受体也能进行磷酸化。Allan J Syms等(1985)利用同位素密度氨基酸法确定雄激素受体在有或缺乏R1881时受体的合成和降解速率,结果表明在缺乏雄激素时,雄激素受体半衰期为3.1h,速解常数KD为0.22每小时;在R1881浓度为1nM时,其半衰期为6.6h,KD为0.11每小时,这说明雄激素诱导雄激素受体增加是通过增加受体半衰期和合成速度。而利用前列腺肿瘤细胞在10nM的R1881中培养2h,然后紫外辐射进行脉冲实验观察到雄激素受体的半衰期为2~2.5h。Jon A. Kemppainen 等(1992)通过用不同的类固醇和抗雄激素物质转染肾细胞(COS Cell,结果发现在低类固醇浓度时,AR与具有生理活性的雄激素有高的结合亲和力,然而在高激素类固醇浓度时则会降低它与AR的亲和力,且AR的核转运和转录活性也会降低;该试验进一步发现具有高亲和力的雄激素与AR相结合,可以诱导AR的磷酸化,提高AR蛋白的稳定性。
AR是类固醇激素受体家族的一个成员。人类的AR基因被定位于x染色体(Xq11-12),包含有8个外显子和7个内含子,全长约90kb。Dennis B. Lubahn等(1989)通过扩增人类AR基因的外显子进行系列分析发现在AR基因类固醇结合区(外显子G)有一个单碱基的突变G→A,导致甲硫氨酸代替颉氨酸,然而在人类AR基因的类固醇结合区的单个碱基突变导致AR基因表达的蛋白质丧失了刺激男性性别发展的功能。
Rohrer(1999)将猪的AR基因定位于X染色体,通过微卫星连锁分析确定AR基因位于图谱上相对位置73CM处。而SeifERT等(1999)将猪AR基因定位于Xq13,用微卫星连锁分析确定AR基因在图谱上相对位置60CM处,并发现在AR基因的第7内含子存在微卫星多态性。
通过用人类AR转染COS-l细胞竞争分析发现下列物质与AR的亲合效力是:甲雄三烯醇>酮>二氢睾酮>睾酮>雌二醇>孕酮(Wayne D.Tilley等,1989)。以上物质对AR亲合力的差异主要是由激素本身结构造成的。若AR的结构发生变化,则相应物质的亲合力也会发生相应的变化。人类AR基因包含有8个外显子(A-H)和7个内含子,一般分为3个结构区:具有转录活性的N-末端(外显子A)、高保守性富含半胱氨酸的DNA结合区(B-C)和激素结合区C-末端(D-H)。Jorge A Simental等(1991)用单向核酸外切酶Ⅲ消化野生型AR使之突变,在猴的肾细胞(Cos Cell)表达,通过研究AR突变基因表达产物发现: ①在AR的激素结合区缺失23个氨基酸,雄激素与AR的结合能力不会消失,仍然保持与野生型AR结合能力的8%~25%;②N端氨基酸(141-338)含有对转录活性至关重要的信号序列。这个区域富含酸性氨基酸残基类似于糖皮质激素受体(Hollenberg S M等,1988); ③AR的N末端和C末端抑制未形成配位体的受体的核转运,这种抑制直到受体与雄激素结合或受体的雄激素主要结合区域缺失才释放。这些结果表明AR蛋白的各功能区是协同作用调控基因转录。Dennis B. Lubahn等(1989)通过试验发现人类AR基因的各外显子存在不同程度的保守系列,特别是B、C、E、G外显子,且各外显子都与人类催乳素受体(hPR)、人类盐皮质激素受体(hMR)、人类糖皮质激素受体(hGR)、人类雌激素受体(hESR)相应的外显子有不同程度的同源性。Wayne D.Tilley等(1988)发现hAR与hPR、hGR和hMR在富含半恍氨酸的DNA结合区(氨基酸557-662)分别是85%、79%和80%;在类固醇结合区(氨基酸669-917)分别是54%、50%和51%。
AR的特异表达与数量性状的关系
Brandstetter 等(2000)选择公牛和阉公牛进行实验,分别从中提取总RNA,然后用RT-PCR进行鉴定研究发现阉公牛与公牛相比单位总RNA中有更高的ARm RNA水平(P<0.01);ARm RNA水平在3种肌肉(夹肌、半键肌、三头肌)中也存在差异(P<0.05),其中夹肌中最低,同时发现在每种肌肉中AR表达模式随年龄增加而有差异(P<0.05),在4~12月龄,在夹肌中的ARm RNA表达水平增加(P<0.05),但在半键肌和三头肌中仍保持不变,饲养制度(方式)不影响肌肉中AR的表达,但出现补偿生长的阉公牛与自由采食的阉公牛和公牛相比ARm RNA水平更高(P<0.01)。结果表明AR表达具有肌肉组织特异性并且它可以通过睾丸激素循环调节,AR表达的调控可以将公牛中的肌肉异速生长模式与阉公牛的补偿生长模式联系起来。
Rohrer等(1998)对F2代梅山和大白杂交猪进行微卫星扫描,并与性状(背膘等)进行连锁分析发现,在猪X染色体(图谱)上63、68、59和61CM处的微卫星与背膘数量性状位点连锁,且差异极显着;另发现在74CM处的微生星与眼肌面积性状相连锁、64CM处的微卫星与胴体长度相连锁,故此,可将猪X染色体的相应区段作为QTLs(背膘等)的侯选区域。
Sauerwein H等(1987)通过对牛的试验研究发现在母牛脖子肌肉中的AR浓度显着高于相同体重的公牛,从而可以得出AR在公牛中的利用率高于母牛;而脖子、肩和后腿中的AR浓度显着高于腹部。A M Btandstetter等(2000)通过研究公牛和阉公牛发现公牛胴体肌肉与阉公牛相比更高(P<0.05),而胴体脂肪更少(P<0.05)。M SNOchonski等(1981)通过试验发现,在去势公猪和母猪中AR与大腿中瘦肉的生长相关;此外,在那些猪中也发现DNA的含量高(P<0.01),从而导致蛋白质与DNA的比例更低(P<0.05)。Erik DAhlberg等(1981)研究发现老鼠肌肉胞液中的DNA含量随着体重增加而减少,这可能是由于激素受体与DNA相互作用的结果。Brandstetter等(1998a,b)研究发现3种肌肉中ARm RNA表达调控差异导致构成肌肉的肌纤维类型、代谢活动和生长模式不同,在公牛中肌纤维类型的改变与年龄相关,这可能是肌纤维的类型依赖AR的表达。