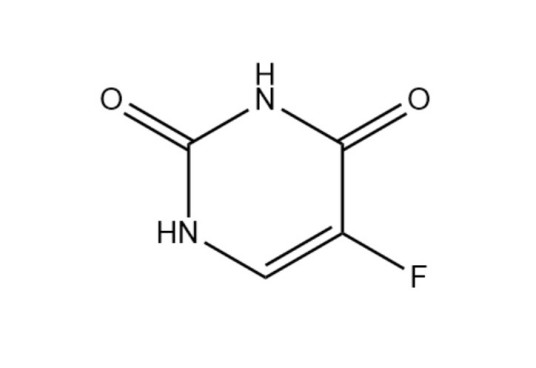
-
氟尿嘧啶 编辑
中文名:氟尿嘧啶
外文名:Fluorouracil
别名:5-氟尿嘧啶、2,4-二羟基-5-氟嘧啶
化学式:C4H3FN2O2
CAS登录号:51-21-8
EINECS登录号:200-085-6
熔点:282至286℃(fen'jie)
水溶性:可溶
外观:白色至几乎白色结晶粉末
闪点:196.5℃
安全性描述:S36/37
危险性符号:Xn
危险性描述:R20/21/22
UN危险货物编号:2811
是否处方药:是
主要适用症:消化道癌及其他实体瘤
基本信息
化学式:C4H3FN2O2
分子量:130.077
CAS号:51-21-8
EINECS号:200-085-6
理化性质
密度:1.53g/cm3
熔点:282-286℃
闪点:196.5℃
折射率:1.542
外观:白色结晶性粉末
溶解性:溶于水,微溶于乙醇,在氯仿中几乎不溶,在稀盐酸或氢氧化钠溶液中溶解
分子结构数据
摩尔折射率:25.85
摩尔体积(cm3/mol):84.5
等张比容(90.2K):220.4
表面张力(dyne/cm):46.1
极化率(10-24cm3):10.24
计算化学数据
疏水参数计算参考值(XlogP):无
氢键供体数量:2
氢键受体数量:3
可旋转化学键数量:0
互变异构体数量:9
拓扑分子极性表面积:58.2
重原子数量:9
表面电荷:0
复杂度:199
同位素原子数量:0
确定原子立构中心数量:0
不确定原子立构中心数量:0
确定化学键立构中心数量:0
不确定化学键立构中心数量:0
共价键单元数量:1
来源
本品为5-氟-2,4(1H,3H)-嘧啶二酮,按干燥品计算,含C4H3FN2O2应为97.0%~103.0%。
性状
本品为白色或类白色的结晶或结晶性粉末。
本品在水中略溶,在乙醇中微溶,在三氯甲烷中几乎不溶,在稀盐酸或氢氧化钠溶液中溶解。
取本品,精密称定,加0.1mol/L盐酸溶液溶解并定量稀释制成每1mL中约含12µg的溶液,照紫外-可见分光光度法(通则0401),在265nm的波长处测定吸光度,吸收系数(E1%1cm)为535~568。
鉴别
1、取本品的水溶液(1→100)5mL,加溴试液1mL,振摇,溴液的颜色即消失,加氢氧化钡试液2mL,生成紫色沉淀。
2、取三氧化铬的饱和硫酸溶液约1mL,置小试管中,转动试管,溶液应能均匀涂于管壁,加本品的细粉约2mg,微热,转动试管,溶液应不能再均匀涂于管壁,而类似油垢存在于管壁。
3、取含量测定项下的供试品溶液,照紫外-可见分光光度法(通则0401)测定,在265nm的波长处有最大吸收,在232nm的波长处有最小吸收。
4、本品的红外光吸收图谱应与对照的图谱(光谱集280图)一致。
检查
含氟量
取本品约15mg,精密称定,照氟检查法(通则0805)测定,含氟量应为13.1%~14.6%。
溶液的澄清度
取本品0.10g,加水10mL溶解后,溶液应澄清,如显浑浊,与1号浊度标准液(通则0902第一法)比较,不得更浓。
氯化物
取本品2.0g,加水100mL,加热使溶解,放冷,滤过,分取滤液25mL,依法检查(通则0801),与标准氯化钠溶液7.0mL制成的对照液比较,不得更浓(0.014%)。
取上述氯化物项下剩余的滤液50mL,依法检查(通则0802),与标准硫酸钾溶液2.0mL制成的对照液比较,不得更浓(0.02%)。
照高效液相色谱法(通则0512)测定。
供试品溶液:取本品,加流动相溶解并稀释制成每1mL中约含0.1mg的溶液。
对照溶液:精密量取供试品溶液适量,用流动相定量稀释制成每1mL中约含0.25µg的溶液。
色谱条件:用十八烷基硅烷键合硅胶为填充剂,以水(用0.05mol/L磷酸溶液调节pH值至3.5)-甲醇(95:5)为流动相,检测波长为265nm,进样体积20µL。
系统适用性要求:理论板数按氟尿嘧啶峰计算不小于2500,氟尿嘧啶峰与相邻杂质峰的分离度应符合要求。
测定法:精密量取供试品溶液与对照溶液,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的5倍。
限度:供试品溶液色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积的2倍(0.5%),各杂质峰面积的和不得大于对照溶液主峰面积的3倍(0.75%)。
干燥失重
取本品,在105℃干燥至恒重,减失重量不得过0.5%(通则0831)。
取本品0.50g,依法检查(通则0821第三法),含重金属不得过百万分之二十。
含量测定
照紫外-可见分光光度法(通则0401)测定。
供试品溶液
取本品,精密称定,加0.1mol/L盐酸溶液溶解并定量稀释制成每1mL中约含10µg的溶液。
测定法
取供试品溶液,在265nm的波长处测定吸光度,按C4H3FN2O2的吸收系数(E1%1cm)为552计算。
类别
抗肿瘤药。
贮藏
遮光,密封保存。
制剂
1、氟尿嘧啶乳膏。
2、氟尿嘧啶注射液。
药理作用
由于5-FU是第一个根据一定设想而合成的抗代谢药并在临床上是应用最广的抗嘧啶类药物,对消化道癌及其他实体瘤有良好疗效,在肿瘤内科治疗中占有重要地位。本品需经过酶转化为5-氟脱氧尿嘧啶核苷酸而具有抗肿瘤活性。5-FU通过抑制胸腺嘧啶核苷酸合成酶而抑制DNA的合成。此酶的作用可能把甲酰四氢叶酸的一碳单位转移给脱氧尿嘧啶核苷-磷酸合成胸腺嘧啶核苷一酸。5-FU对RNA的合成也有一定抑制作用。5-FU可以静脉及腔内注射。5-氟尿嘧啶对膀胱癌病人以恒定速率连续滴的本剂后发现,用药浓度最低在10时,而在22时~3时之间用药浓度最高。在不用恒速滴的时,将流速峰值定在凌晨4时,则允许极大地提高剂量而毒性极低,疗效因之增强。本品必须在体内经核糖基化和磷酰化等生物转化作用后,才具有细胞毒性。5-FU可经不同途径生成F-dUMP和FUMP。前者可与胸苷酸合成酶的活性中心共价结合,抑制此酶的活性,使脱氧核苷酸缺乏,DNA合成障碍。此外,5-FU的代谢物也可以伪代谢物形式掺入到RNA和DNA中,影响细胞功能,产生细胞毒性。5-FU是一种不典型的细胞周期特异性药,它除了主要作用于S期外,对其他期的细胞亦有作用。
副作用
1、胃肠道反应有食欲不振、恶心、呕吐、口腔炎、胃炎、腹痛及腹泻。严重者有血性腹泻或便血,应立即停药,给以对症治疗,否则可致生命危险。
4、有脱发、皮肤或指甲色素沉着等。
6、能生成神经毒性代谢物——氟代柠檬酸而致脑瘫,故不作鞘内注射。
药代动力学
本品口服吸收不完全且难以预测,故注射给药,静注后迅速分布到全身各组织:脑脊液和肿瘤组织中。如上所述,5-FU在体内才转化成活性核苷酸代谢产物而起作用。代谢降解可在许多组织中进行,尤其是在肝脏。5-FU在肝、肠粘膜和其他组织内的二氢嘧啶还原酶的作用下,嘧啶环被还原为5-氟-5,6-二氢尿嘧啶而失活。如若因遗传而缺乏此酶,则对该药的敏感性大大增加,极少数人可因缺乏此酶而对常用剂量的5-FU表现出很强的药物毒性。5-FU最终的代谢产物为α-氟-β-丙氨酸。快速静注5-FU血浆浓度可达0.1~0.3。
适应症
5-FU对多种肿瘤如消化道肿瘤、乳腺癌、卵巢癌、绒毛膜上皮癌、子宫颈癌、肝癌、膀胱癌、皮肤癌(局部涂抹)外阴白斑(局部涂抹)等均有一定疗效。单独或与其他药物联合应用于乳腺癌和胃肠道肿瘤手术辅助治疗,也用于一些非手术恶性肿瘤的姑息治疗,尤其是那些胃肠道、乳腺、头颈部、肝、泌尿系统和胰腺的恶性肿瘤。以往经验表明5-FU对转移性乳腺癌和胃肠道肉瘤部分反应率为10%~30%。5-FU与某些其他药物联合应用常可获较高的反应率、存活率。如合用环磷酰胺和MTX(乳腺癌)、顺铂(卵巢和头颈部癌)、醛氢叶酸(结直肠癌)虽可提高5-UF活性,但也增加其毒性。5-FU联合应用左旋咪唑(免疫兴奋、副作用弱)治疗结直肠癌可降低疾病的复发率,提高术后存活率。5-FU局部外敷治疗皮肤基底细胞癌有效,对严重的难治性牛皮癣亦有效。
用法用量
①静脉注射,1次0.25-0.5g,1日或隔日1次,一疗程总量5~10g。
②静脉滴注,1次0.25~0.75g,1日1次或隔日1次,一疗程总量8-10g。治疗绒毛膜上皮癌时可将剂量加大到每日25~30mg/kg,溶于5%葡萄糖液500~1000mL中点滴6~8小时,每10天为1疗程。
对造血功能和营养状态良好的病人,推荐剂量为静注每日12mg/kg,每日最大剂量为800mg。注射4d后,如未发现毒性,接着改为6mg/kg剂量,隔日1次,共用4次。
间歇4周再开始下一疗程;并根据疗效及耐受情况调整剂量。
静脉输注:每日15~30mg/kg,在6~8h内缓慢滴注完毕,连用10d为一疗程。
口服,150~300mg/d,分次服用。总量10~15g为一疗程。
外用:5%霜剂或10%、5%丙二醇溶液剂抹擦。
不良反应
1、骨髓抑制:主要为白细胞减少、血小板下降。
2、食欲不振、恶心、呕吐、口腔炎、胃炎、腹痛及腹泻等胃肠道反应。
4、其他:常有脱发、红斑性皮炎、皮肤色素沉着手足综合征及暂时性小脑运动失调,偶有影响心脏功能。
注意事项
用药期间应严格检查血象。避光置阴暗处保存,温度不应低于10℃,亦不宜超过35℃。治疗期涂药范围有炎症,停药后炎症消退。本品可引起严重的皮肤刺激,尤其在日光下。该药还可经皮损内注射给药用于角化棘皮病、疣和汗孔角化病。其主要副作用为注射期间有灼烧感,继之有局部红斑、水肿甚至溃疡。
除醛氢叶酸外,许多药物可与5-FU联合应用以增强细胞毒性,临床上最感兴趣的与5-FU联合应用的药物有:
(1)MTX:通过抑制瞟呤代谢和增加细胞池PRPP,MTX可增强5-FU合成代谢,增加RNA中的掺入,增加5-FU的活化。因此,当MTX用在5-FU前,可增加5-FU活性。
(2)干扰素:减少胸苷酸合成酶的“反跳”合成。
(3)醛氢叶酸:增强对胸苷合成酶的抑制。
(4)顺铂:增强DNA链断裂,继发配对减少,增强对胸苷合成酶的抑制。
(5)尿嘧啶:减少RNA掺入。此外,抑制嘧啶早期合成步骤的药物,PALA(N-phosphoNO-acetyl-L-aspartate)可通过抑制门冬氨酸转氨基甲酰酶,与5-FU产生协同作用,但是这些联合用药没有被证明有临床价值。
(6)人参皂苷rh2:减轻药物毒副作用,人参皂苷Rh2可以作为肿瘤耐药逆转剂提高化疗药物的抗肿瘤活性。一般的化疗药物不易进入癌细胞,癌细胞中有种P-糖蛋白可将化疗药物排出,在细胞膜与磷蛋白结合,造成癌细胞对化疗药物产生耐受性差,Rh2具有可亲水及亲油的特性,可以轻易进入细胞核内而杀死癌细胞。
药物相互作用
与甲酰四氢叶酸或顺铂合用,其抗肿瘤疗效明显提高。本品与甲氨蝶呤亦存在相互作用。氟尿嘧啶用药在先,甲氨蝶呤用药在后则产生抵抗;反之,先用甲氨蝶呤,4小时~6小时后再用氟尿嘧啶则产生抗肿瘤协同作用。
编号 | 毒性类型 | 测试对象 | 使用剂量 | 毒性作用 | |
|---|---|---|---|---|---|
1 | 急性毒性 | 口服 | 人类 | 450 mg/kg/30D | 胃肠道毒性——其他变化 致癌性——有抗肿瘤、抗癌活性 |
2 | 急性毒性 | 静脉注射 | 人类 | 6 mg/kg/3D | 心脏毒性——其他变化 |
3 | 急性毒性 | 静脉注射 | 成年女性 | 150 mg/kg/17W-I | |
4 | 急性毒性 | 静脉注射 | 成年男性 | 39 mg/kg/1D-I | 心脏毒性——冠状动脉发生变化 |
5 | 急性毒性 | 静脉注射 | 成年女性 | 27 mg/kg/4D-C | 心脏毒性——其他变化 |
6 | 急性毒性 | 静脉注射 | 成年男性 | 122 mg/kg/9W-I | 皮肤和附件毒性——皮炎 (全身暴露后) |
7 | 急性毒性 | 口服 | 大鼠 | 230 mg/kg | 详细作用没有报告除致死剂量以外的其他值 |
8 | 急性毒性 | 腹腔注射 | 大鼠 | 70 mg/kg | 胃肠道毒性——运动过度、腹泻 胃肠道毒性——恶心、呕吐 |
9 | 急性毒性 | 大鼠 | 217 mg/kg | 详细作用没有报告除致死剂量以外的其他值 | |
10 | 急性毒性 | 静脉注射 | 大鼠 | 245 mg/kg | 胃肠道毒性——运动过度、腹泻 胃肠道毒性——恶心、呕吐 |
11 | 急性毒性 | 大鼠 | 240 mg/kg | 详细作用没有报告除致死剂量以外的其他值 | |
12 | 急性毒性 | 肠外 | 大鼠 | 500 mg/kg | 详细作用没有报告除致死剂量以外的其他值 |
13 | 急性毒性 | 直肠注射 | 大鼠 | 884 mg/kg | 胃肠道毒性——运动过度、腹泻 胃肠道毒性——其他变化 |
14 | 急性毒性 | 口服 | 115 mg/kg | 详细作用没有报告除致死剂量以外的其他值 | |
15 | 急性毒性 | 腹腔注射 | 小鼠 | 100 mg/kg | 详细作用没有报告除致死剂量以外的其他值 |
16 | 急性毒性 | 皮下注射 | 小鼠 | 169 mg/kg | 详细作用没有报告除致死剂量以外的其他值 |
17 | 急性毒性 | 静脉注射 | 小鼠 | 81 mg/kg | 详细作用没有报告除致死剂量以外的其他值 |
18 | 急性毒性 | 脑注射 | 小鼠 | 41600 μg/kg | 周围神经毒性——感官发生变化 眼毒性——上睑下垂 眼毒性——未报告 |
19 | 急性毒性 | 小鼠 | 200 mg/kg | 营养和代谢系统毒性——体重下降或体重增加速率下降 | |
20 | 急性毒性 | 未报告 | 小鼠 | 171 mg/kg | 详细作用没有报告除致死剂量以外的其他值 |
21 | 急性毒性 | 口服 | 狗 | 30 mg/kg | 胃肠道毒性——恶心、呕吐 |
22 | 急性毒性 | 口服 | 兔 | 18900 μg/kg | 行为毒性——肌肉无力 胃肠道毒性——运动过度、腹泻 营养和代谢系统毒性——体重下降或体重增加速率下降 |
23 | 急性毒性 | 静脉注射 | 兔 | 15 mg/kg | |
24 | 急性毒性 | 静脉注射 | 25 mg/kg | ||
25 | 急性毒性 | 肠外 | 仓鼠 | 140 mg/kg | 致癌性——有抗肿瘤、抗癌活性 |
26 | 慢性毒性 | 口服 | 大鼠 | 2520 mg/kg/12W-I | 血液毒性——骨髓发生变化 |
27 | 慢性毒性 | 口服 | 大鼠 | 1092 mg/kg/30D-I | 内分泌毒性——胸腺重量变化 血液毒性——正细胞性贫血 |
28 | 慢性毒性 | 口服 | 大鼠 | 6552 mg/kg/26W-I | 内分泌毒性——胸腺重量变化 肝毒性——肝重量发生变化 血液毒性——红细胞计数发生变化 |
29 | 慢性毒性 | 口服 | 大鼠 | 700 mg/kg/40W-I | 营养和代谢系统毒性——体重下降或体重增加速率下降 血液毒性——血清成分发生变化 生化毒性——抑制转氨酶活性、改变了转氨酶空间结构 |
30 | 慢性毒性 | 口服 | 大鼠 | 1283 mg/kg/13W-C | 行为毒性——液体摄入量发生变化 内分泌毒性——胸腺重量变化 营养和代谢系统毒性——体重下降或体重增加速率下降 |
31 | 慢性毒性 | 腹腔注射 | 大鼠 | 910 mg/kg/26W-I | 胃肠道毒性——其他变化 血液毒性——红细胞计数发生变化 |
32 | 慢性毒性 | 腹腔注射 | 大鼠 | 360 mg/kg/60D-I | 慢性病相关毒性——死亡 |
33 | 慢性毒性 | 腹腔注射 | 大鼠 | 780 mg/kg/30D-I | 内分泌毒性——胸腺重量变化 血液毒性——正细胞性贫血 生化毒性——抑制转氨酶活性、改变了转氨酶空间结构 |
34 | 慢性毒性 | 腹腔注射 | 大鼠 | 2340 mg/kg/13W-I | 肝毒性——肝重量发生变化 肾、输尿管和膀胱毒性——膀胱重量发生变化 血液毒性——正细胞性贫血 |
35 | 慢性毒性 | 皮下注射 | 大鼠 | 21 mg/kg/7D-I | 血液毒性——骨髓发生变化 血液毒性——白细胞计数发生变化 血液毒性——血小板计数发生变化 |
36 | 慢性毒性 | 直肠注射 | 大鼠 | 4920 mg/kg/90D-I | 胃肠道毒性——其他变化 内分泌毒性——其他变化 营养和代谢系统毒性——体重下降或体重增加速率下降 |
37 | 慢性毒性 | 直肠注射 | 大鼠 | 9540 mg/kg/26W-I | 胃肠道毒性——其他变化 内分泌毒性——其他变化 慢性病相关毒性——死亡 |
38 | 慢性毒性 | 皮下注射 | 小鼠 | 300 mg/kg/60D-I | 内分泌毒性——脾脏重量发生变化 慢性病相关毒性——死亡 慢性病相关毒性——睾丸重量发生变化 |
39 | 慢性毒性 | 口服 | 狗 | 455 mg/kg/13W-I | 行为毒性——影响食物摄入量 (动物) 营养和代谢系统毒性——体重下降或体重增加速率下降 慢性病相关毒性——死亡 |
40 | 慢性毒性 | 口服 | 狗 | 175 mg/kg/5W-I | 血液毒性——骨髓发生变化 慢性病相关毒性——死亡 |
41 | 慢性毒性 | 口服 | 猫 | 182 mg/kg/13W-I | 行为毒性——影响食物摄入量 (动物) 行为毒性——共济失调 行为毒性——精神受到抑制 |
42 | 眼部毒性 | 皮肤表面 | 人类 | 84 mg/3W | |
43 | 突变毒性 | 26 mg/L | |||
44 | 突变毒性 | 大肠埃希氏菌 | 10 mg/L | ||
45 | 突变毒性 | 大肠埃希氏菌 | 167 mg/L | ||
46 | 突变毒性 | 大肠埃希氏菌 | 10 μg/plate | ||
47 | 突变毒性 | 300 μg/plate | |||
48 | 突变毒性 | 枯草芽孢杆菌 | 1 mg/L | ||
49 | 突变毒性 | 2 mmol/L | |||
50 | 突变毒性 | 微生物 | 125 mg/L | ||
51 | 突变毒性 | 微生物 | 125 mg/L | ||
52 | 突变毒性 | 微生物 | 1 mg/L | ||
53 | 突变毒性 | 微生物 | 200 mg/L | ||
54 | 突变毒性 | 微生物 | 300 mg/L | ||
55 | 突变毒性 | 微生物 | 2 mmol/L | ||
56 | 突变毒性 | 微生物 | 50 mg/L | ||
57 | 突变毒性 | 微生物 | 400 mg/L | ||
58 | 突变毒性 | 微生物 | 16 μmol/L | ||
59 | 突变毒性 | 口服 | 5 mmol/L/6h | ||
60 | 突变毒性 | 粗糙脉孢菌 | 20 μg/disc | ||
61 | 突变毒性 | 酿酒酵母 | 8 mg/L | ||
62 | 突变毒性 | 15 μg/L | |||
63 | 突变毒性 | 粟酒裂殖酵母 | 10 μg/L | ||
64 | 突变毒性 | 肠外 | InseCT ed | 10 μg | |
65 | 突变毒性 | 肠外 | InsECT ed | 10 μg | |
66 | 突变毒性 | 人类细胞 | 13 mg/L | ||
67 | 突变毒性 | 人类细胞 | 1 mmol/L | ||
68 | 突变毒性 | 人类细胞 | 5 μmol/L/6h | ||
69 | 突变毒性 | 人类白细胞 | 2600 nmol/L | ||
70 | 突变毒性 | 人类白细胞 | 2600 nmol/L | ||
71 | 突变毒性 | 人类 细胞 | 20 mg/L | ||
72 | 突变毒性 | 人类 细胞 | 1 mmol/L | ||
73 | 突变毒性 | 人类 细胞 | 1 mmol/L | ||
74 | 突变毒性 | 人类 细胞 | 200 mg/L | ||
75 | 突变毒性 | 人类 细胞 | 1 μmol/L | ||
76 | 突变毒性 | 人类 细胞 | 1 μmol/L | ||
77 | 突变毒性 | 人类卵巢 | 1 mg/L | ||
78 | 突变毒性 | 皮肤表面 | 人类 | 1 pph | |
79 | 突变毒性 | 人类 细胞 | 1 mg/L | ||
80 | 突变毒性 | 海拉细胞 | 50 mg/L | ||
81 | 突变毒性 | 人类鼠伤寒沙门氏菌 | 7 mg/kg | ||
82 | 突变毒性 | 人类淋巴细胞 | 100 pmol/L | ||
83 | 突变毒性 | 腹腔注射 | 大鼠 | 250 mg/kg | |
84 | 突变毒性 | 腹腔注射 | 大鼠 | 50 mg/kg | |
85 | 突变毒性 | 腹腔注射 | 小鼠 | 12500 μg/kg | |
86 | 突变毒性 | 腹腔注射 | 小鼠 | 26018 μg/kg | |
87 | 突变毒性 | 小鼠胚胎 | 10 μmol/L/24h | ||
88 | 突变毒性 | 小鼠骨髓 | 20 μmol/L | ||
89 | 突变毒性 | 小鼠骨髓 | 19 μmol/L | ||
90 | 突变毒性 | 小鼠淋巴细胞 | 66 μmol/L | ||
91 | 突变毒性 | 腹腔注射 | 小鼠 | 500 μmol/kg | |
92 | 突变毒性 | 静脉注射 | 小鼠 | 40 mg/kg | |
93 | 突变毒性 | 口服 | 小鼠 | 40 mg/kg | |
94 | 突变毒性 | 小鼠腹水瘤细胞 | 40 mg/L | ||
95 | 突变毒性 | 小鼠腹水瘤细胞 | 40 mg/L | ||
96 | 突变毒性 | 腹腔注射 | 小鼠 | 50 mg/kg | |
97 | 突变毒性 | 小鼠白细胞 | 3 mg/L | ||
98 | 突变毒性 | 小鼠白细胞 | 100 mg/kg | ||
99 | 突变毒性 | 小鼠白细胞 | 55 μmol/L | ||
100 | 突变毒性 | 小鼠淋巴细胞 | 500 μg/L | ||
101 | 突变毒性 | 腹腔注射 | 小鼠 | 50 mg/kg | |
102 | 突变毒性 | 口服 | 小鼠 | 40 mg/kg | |
103 | 突变毒性 | 小鼠胚胎 | 100 nmol/L | ||
104 | 突变毒性 | 小鼠骨髓 | 1800 nmol/L | ||
105 | 突变毒性 | 小鼠腹水瘤细胞 | 7500 μmol/L | ||
106 | 突变毒性 | 小鼠 细胞 | 1 μg/L | ||
107 | 突变毒性 | 口服 | 小鼠 | 50 mg/kg | |
108 | 突变毒性 | 腹腔注射 | 小鼠 | 20 mg/kg | |
109 | 突变毒性 | 小鼠腹水瘤细胞 | 250 mg/kg | ||
110 | 突变毒性 | 腹腔注射 | 小鼠 | 50 mg/kg | |
111 | 突变毒性 | 静脉注射 | 小鼠 | 50 mg/kg | |
112 | 突变毒性 | 腹腔注射 | 仓鼠 | 41 mg/kg | |
113 | 突变毒性 | 腹腔注射 | 仓鼠 | 41 mg/kg | |
114 | 突变毒性 | 仓鼠肺 | 1900 μg/L | ||
115 | 突变毒性 | 哺乳动物细胞 | 100 μmol/L | ||
116 | 致癌性 | 腹腔注射 | 小鼠 | 1500 mg/kg/50W-I | 致癌性——致癌(根据RTECS标准) 肺部、胸部或者呼吸毒性——肿瘤 血液毒性——肿瘤 |
117 | 生殖毒性 | 静脉注射 | 成年女性 | 150 mg/kg,雌性受孕 20-31 周后 | 生殖毒性——对新生儿有其他影响 |
118 | 生殖毒性 | 静脉注射 | 成年女性 | 240 mg/kg,雌性受孕 11-14 周后 | |
119 | 生殖毒性 | 口服 | 大鼠 | 35 mg/kg,雌性受孕 7-13 天后 | 生殖毒性——肌肉骨骼系统发育异常 |
120 | 生殖毒性 | 口服 | 大鼠 | 175 mg/kg,雌性受孕 7-13 天后 | 生殖毒性——影响产仔数 生殖毒性——胎儿毒性 (如胎儿发育不良,但不至死亡) 生殖毒性——胚胎或胎儿死亡 |
121 | 生殖毒性 | 腹腔注射 | 大鼠 | 13500 μg/kg,雌性受孕 9 天后 | 生殖毒性——植入后死亡率增加 生殖毒性——胎儿毒性 (如胎儿发育不良,但不至死亡) 生殖毒性——胚胎或胎儿死亡 |
122 | 生殖毒性 | 腹腔注射 | 大鼠 | 15 mg/kg,雌性受孕 9 天后 | 生殖毒性——植入后死亡率增加 生殖毒性——胚胎或胎儿死亡 生殖毒性——其他发育异常 |
123 | 生殖毒性 | 腹腔注射 | 大鼠 | 30 mg/kg,雌性受孕 12 天后 | 生殖毒性——颅骨和面部发育异常 (包括鼻/舌) 生殖毒性——肌肉骨骼系统发育异常 生殖毒性——胃肠道系统发育异常 |
124 | 生殖毒性 | 腹腔注射 | 大鼠 | 30 mg/kg,雌性受孕 12 天后 | 生殖毒性——机体稳态发育异常 |
125 | 生殖毒性 | 腹腔注射 | 大鼠 | 20 mg/kg,雌性受孕 9 天后 | 生殖毒性——植入后死亡率增加 生殖毒性——胎儿毒性 (如胎儿发育不良,但不至死亡) 生殖毒性——其他发育异常 |
126 | 生殖毒性 | 皮下注射 | 大鼠 | 20 mg/kg,雌性受孕 14 天后 | 生殖毒性——胎儿毒性 (如胎儿发育不良,但不至死亡) |
127 | 生殖毒性 | 皮下注射 | 大鼠 | 30 mg/kg,雌性受孕 14 天后 | 生殖毒性——肌肉骨骼系统发育异常 |
128 | 生殖毒性 | 静脉注射 | 大鼠 | 330 mg/kg,雌性受孕 7-17 天后 | 生殖毒性——肌肉骨骼系统发育异常 |
129 | 生殖毒性 | 口服 | 小鼠 | 175 mg/kg,雌性受孕 7-13 天后 | 生殖毒性——胎儿毒性 (如胎儿发育不良,但不至死亡) 生殖毒性——肌肉骨骼系统发育异常 |
130 | 生殖毒性 | 口服 | 小鼠 | 245 mg/kg,雌性受孕 7-13 天后 | 生殖毒性——影响产仔数 生殖毒性——胚胎或胎儿死亡 |
131 | 生殖毒性 | 腹腔注射 | 小鼠 | 50 mg/kg,雌性受孕 13 天后 | 生殖毒性——影响胎儿或胚胎细胞遗传物质 |
132 | 生殖毒性 | 腹腔注射 | 小鼠 | 20 mg/kg,雌性受孕 10 天后 | 生殖毒性——肌肉骨骼系统发育异常 生殖毒性——颅骨和面部发育异常 (包括鼻/舌) |
133 | 生殖毒性 | 腹腔注射 | 小鼠 | 20 mg/kg,雌性受孕 9 天后 | 生殖毒性——植入后死亡率增加 生殖毒性——其他发育异常 |
134 | 生殖毒性 | 腹腔注射 | 小鼠 | 30 mg/kg,雌性受孕 9 天后 | 生殖毒性——流产 |
135 | 生殖毒性 | 腹腔注射 | 小鼠 | 10 mg/kg,雌性受孕 10 天后 | 生殖毒性——耳/眼发育异常 生殖毒性——肌肉骨骼系统发育异常 |
136 | 生殖毒性 | 腹腔注射 | 小鼠 | 30 mg/kg,雌性受孕 12 天后 | 生殖毒性——影响新生儿活产指数 生殖毒性——影响新生儿活力指数 (如在出生第4天还活着) 生殖毒性——新生儿体重增加量减少 |
137 | 生殖毒性 | 静脉注射 | 小鼠 | 67 mg/kg,雄性配种 1 天前 | 生殖毒性——雄性生精功能异常 |
138 | 生殖毒性 | 肌肉注射 | 仓鼠 | 24 mg/kg,雌性受孕 9 天后 | 生殖毒性——胎儿毒性 (如胎儿发育不良,但不至死亡) 生殖毒性——颅骨和面部发育异常 (包括鼻/舌) |
139 | 生殖毒性 | 肌肉注射 | 仓鼠 | 28 mg/kg,雌性受孕 9 天后 | 生殖毒性——植入后死亡率增加 生殖毒性——肌肉骨骼系统发育异常 |
140 | 生殖毒性 | 肌肉注射 | 仓鼠 | 56 mg/kg,雌性受孕 11 天后 | 生殖毒性——机体稳态发育异常 |
141 | 生殖毒性 | 肌肉注射 | 仓鼠 | 20 mg/kg,雌性受孕 9 天后 | 生殖毒性——植入后死亡率增加 |
安全术语
S36/37:Wear suitable protective clothing and gloves.
穿戴适当的防护服和手套。
风险术语
R20/21/22:Harmful by inhalation, in contact with skin and if swallowed.
吸入、与皮肤接触和吞食是有害的。