-
多原子分子 编辑
中文名:多原子分子
外文名:polyatomicmolecule
对比:单原子分子
多原子分子的空间构型是由实验测得的键长、键 角决定的。对于简单无机小分子的空间构型可以用价层电子对互斥理论(Valence Shell EleCTron Pair Repulsion)解释,简称VSEPR理论。
价层电子对互斥理论认为
1、分子或离子的空间构型取决于中心原子周围的价层电子对数。价层电子对是指与中心原子成键的成键电子对(σ键电子对)及中心原子未成键的孤电子对。
2、价层电子对间尽可能远离以使斥力最小。在共价分子(或离子)中,中心原子价电子层(简称价层)中的电子对(称价电子对,包括成键电子对和未成键的孤电子对)倾向于尽可能地远离,以使彼此间相互排斥作用为最小。
3、VSEPR理论把分子中中心原子的价电子层视为一个球面,价电子对按能量最低原理排布在球面,从而决定分子的空间构型。价电子对的排布方式见图1:
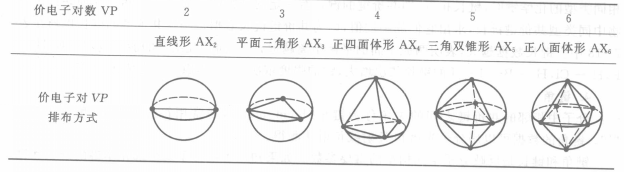 图1 中心原子价电子对排布方式
图1 中心原子价电子对排布方式
多原子分子是否有极性,既取决于键的极性,又取决于分子的构型。所谓分子构型,就是分子中各种原子或原子团在空间中的排布顺序。
键的极性
1、如果多原子分子中所有的键都是非极性键,则分子也是非极性的。如白磷P4是正四面体型的,它就是非极性的。
2、如果多原子分子中,若键有极性,它的分子是否有极性,就进一步取决于分子的构型。
分子构型
1、若分子的构型是对称的,则此分子为非极性分子。
例如,CCl4的C—Cl键是极性键,但是由于分子的构型是对称的使极性相互抵消,偶极矩的总和为零,所以它是非极性共价化合物。属于此类的物质很多,如CO2、CH4、BeH2等。
2、分子的构型是非对称的,则此分子为极性分子。
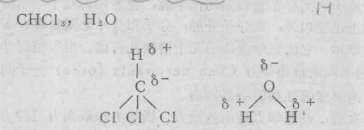 分子构型
分子构型
由于构型的不对称性,所以偶极矩不为零,它们都是极性共价化合物。










