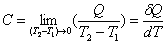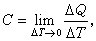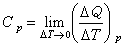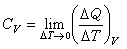-
热容 编辑
在不发生相变化和化学变化的前提下,系统与环境所交换的热与由此引起的温度变化之比称为系统的热容。系统与环境交换热的多少应与物质种类、状态、物质的量和交换的方式有关。因此,系统的热容值受上述各因素的影响。另外,温度变化范围也将影响热容值,即使温度变化范围相同,系统所处的始、末状态不同,系统与环境所交换的热值也不相同。所以,由某一温度变化范围内测得的热交换值计算出的热容值,只能是一个平均值,称为平均热容。即
C平均=Q/ΔT
当温度变化时,平均热容就很难反映系统的真实状态。为此提出了热容的概念,其定义式为
C=δQ/dT
热容的单位为J·K-1,是系统的广度性质。1mol物质的热容称为摩尔热容,以Cm表示,单位为J·mol-1·K-1,C=nCm;单位质量物质的热容称为比热容。
由于物体在不同温度时升高1K所需热不同,因此在某一温度T时物体的热容C的严格定义是lim代表T2趋近于T1的极限,δQ表示无限小量热比区别于状态函数的全微如dT。
组成不变的均相封闭系统,系统吸收热的多少与温度升高的幅度成正比。热力学规定:在不做非体积功的情况下,一个不发生化学变化和相变化的封闭系统,温度每升高1℃所需要的热称为热容。用符号C表示,单位:J/K。
C=δQ/dT
在一定温度区间ΔT内,系统吸收的热Q与温度变化幅度的比值称为平均热容。热容不仅与系统的性质有关,还与系统中所含物质的数量有关。单位质量的物质温度每升高1℃所需要的热称为比热容,简称比热,单位:J/(K·g)或J/(K·kg)。1mol物质温度每升高1℃所需要的热称为摩尔热容,用符号Cm表示,单位:J/(K·mol)或者J/(mol·K)。
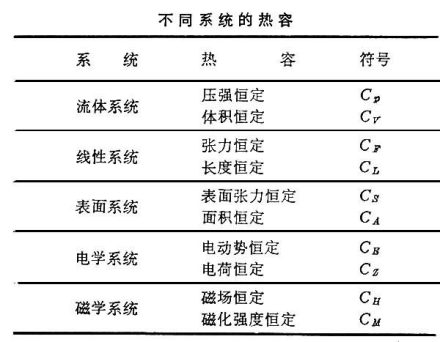
因为热与过程有关,所以系统的热容也与过程有关。封闭系统恒容过程的热容称为恒容热容,用CV表示,摩尔恒容热容用符号CV,m表示
CV=nCV,m=δQV/dT
在不做非体积功的情况下,封闭体系的恒容过程δQV=dU。
由此可见,在无化学变化和相变且不做非体积功的过程中,恒容热容又等于封闭系统的热力学能随温度的变化率。从上式可得
dU=CVdT=nCV,mdT
利用上式可以计算封闭系统无化学变化和相变且不做非体积功的过程中的热力学能变。若恒容热容与温度无关,则
ΔU=CV(T2-T1)=nCV,m(T2-T1)
同样,封闭系统的恒压热容用符号Cp表示,摩尔恒压热容用符号Cp,m表示,公式同上。
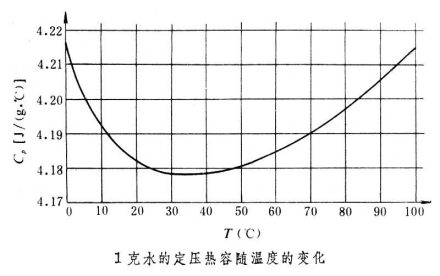
对于单元二相系,还可以引入二相平衡热容的概念。以C1表示相1的二相平衡热容,其定义是在加热过程中保持相1同相2平衡的条件下,使处于相1的物质温度升高1K所吸收的热量。C2表示相2的二相平衡热容,即在加热过程中保持相2同相1平衡,使处于相2的物质温度升高1K所吸收的热量。计算表明,一定质量水的二相平衡热容同水的定压热容相差很少。