-
磷酸 编辑
中文名:磷酸
外文名:Phosphoricacid
别名:正磷酸
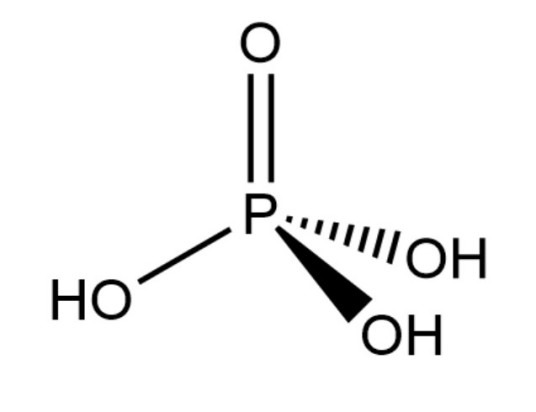
化学式:H3PO4
分子量:97.995
CAS登录号:7664-38-2
EINECS登录号:231-633-2
熔点:42℃(无水物)
沸点:261℃(无水物)
水溶性:100(无限混溶)
密度:1.874g/mL(液态)
外观:透明无色液体
应用:主要用于制药、食品、肥料等工业,也可用作化学试剂
安全性描述:S1/2;S7;S16;S24/25;S26;S36/37/39;S45
危险性符号:C
危险性描述:R34
UN危险货物编号:3453
酸性强度:中强酸
气味:无刺激性气味
继德国商人波兰特发现磷、德国化学家孔克尔制出磷后,英国化学家波义耳也独立制出了磷,他也是最早研究磷性质及化合物的化学家,他在1682年发表的论文《一种观察到的冷光的新实验》中写到“磷在燃烧后生成白烟,白烟与水作用后生成的溶液具有酸性。”其中的白烟正是磷酸酐(五氧化二磷),而与水作用生成的溶液即为磷酸,然而他并未对磷酸进行进一步的研究。
研究磷酸最早的化学家是法国化学家拉瓦锡。1772年,他做这样的实验:将磷放在以汞密封的钟罩里使其燃烧。实验结果而得出这样的结论:一定量的磷能燃烧于某容量的空气中;磷燃烧时生成无水磷的白色粉片,如细雪一般;燃烧后瓶中的空气约剩原来容量的80%;磷燃烧后较燃烧前约重2.5倍;白色粉片溶于水即成磷酸。拉瓦锡还证明磷酸可用浓硝酸和磷反应制得。
大约过了一百多年,德国化学家李比希做了许多农业化学的实验,揭开磷和磷酸对植物生命的价值。1840年李比希著的《有机化学在农业和生理学上的作用》中,科学地论证了土壤的肥力问题,并指出磷对植物的作用。同时,他还进一步探究了磷酸及磷酸盐作为肥料的应用,从此磷酸的生产进入大规模化时代。
正磷酸是由一个单一的磷氧四面体构成的磷酸。在磷酸分子中P原子是sp3杂化的,3个杂化轨道与氧原子间形成3个σ键,另一个P—O键是由一个从磷到氧的σ配键和两个由氧到磷的d-p配键组成的。σ配键是磷原子上的一对孤对电子向氧原子的空轨道配位而形成。d←p配键是氧原子的py、pz轨道上的两对孤对电子和磷原子的dxz、dyz空轨道重叠而成。由于磷原子3d能级比氧原子的2p能级能量高很多,组成的分子轨道不是很有效的,所以P—O键从数目上来看是三重键,但从键能和键长来看是介于单键和双键之间。纯H3PO4和它的晶体水合物中都有氢键存在,这可能是磷酸浓溶液粘稠的原因。
比电导
常温下(219K),H3PO4溶液浓度为45%—47%时比电导最大。
溶解性
磷酸与水可以无限比例混溶,但同时与水发生脱水-水合的平衡反应。当含水量低于5%时,逐渐开始脱水生成焦磷酸。
结晶点
磷酸结晶点与含水量有关。无水磷酸结晶点为42℃,62.5%磷酸/37.5%水的混合体系达到低共熔点,结晶点为-85℃。
市售磷酸通常质量分数85%,其结晶点(冰点)为21℃,当低于此温度时会析出半水物结(冰)晶。当然,通常磷酸在10℃以上甚至更低温度下也不结(冰)晶,这是由于磷酸具有过冷的特性,也就是实际上市售的磷酸在低于21℃时会偏离其结(冰)晶点,不会立即结(冰)晶的现象存在。但这样的低温只要维持一段时间,在静止的状态下,磷酸很容易产生结(冰)晶。
磷酸结晶就像其他液体结晶一样属于物理变化而非化学变化。其化学性质不会因结晶而改变,也即磷酸的性质是不会因结晶而受影响的,只要给予温度熔化或加热水稀释溶化,仍可以正常使用。
结晶特性:磷酸浓度高、纯度高,结晶性高。根据经验,当气温在4摄氏度上下,浓度大于85%时,其结晶性增大,若不慎混入结(冰)晶磷酸,会造成原本没有结(冰)晶的磷酸立即感染而结(冰)晶,而且磷酸结(冰)晶异常迅速,直致磷酸储存容器大部结(冰)晶。磷酸结(冰)晶后,上部磷酸变稀,下部沉积针状结(冰)晶体纯磷酸。根据经验,75%磷酸在较低(4℃附近)的温度下也较难结(冰)晶,因此在较低的气温条件下,建议使用75%磷酸比较妥当。
磷酸结(冰)晶好比水结冰,是其本身的物理性质,固有属性,不能改变,只有妥善保存处理才能防止结(冰)晶。市售磷酸是含85%H3PO4的粘稠状浓溶液。从浓溶液中结晶,则形成半水合物2H3PO4·H2O(熔点302.3K)。
沸点
市售磷酸是含水的混合物,其沸点与含水量有关,含水量越低则沸点越高。质量分数85%的磷酸沸点为158℃。无水磷酸沸点为261℃,此时发生脱水反应生成沸点更高的焦磷酸。
磷酸是三元中强酸,分三步电离,不易挥发,不易分解,有一定氧化性。具有酸的通性。
pKa1:2.12
pKa2:7.20
pKa3:12.36
(1)浓磷酸可以和氯化钠共热生成氯化氢气体(与碘化钾、溴化钠等也有类似反应),属于高沸点酸制低沸点酸:
原理:难挥发性酸制挥发性酸
(2)磷酸根离子具有很强的配合能力,能与许多金属离子生成可溶性的配合物。如Fe3+与PO43-可以生成无色的可溶性的配合物3-和-,利用这一性质,分析化学上常用PO43-掩蔽Fe3+离子,浓磷酸能溶解钨、锆、硅、硅化铁等,并与他们形成配合物。
(3)磷酸受强热时脱水,依次生成多聚磷酸,焦磷酸、三磷酸和多聚偏磷酸。三磷酸是链状结构,多聚的偏磷酸是环状结构。
(4)需要特别注意的是,浓热的磷酸能腐蚀二氧化硅,生成杂多酸。浓热磷酸还能分解绝大部分矿物,如铬铁矿、金红石、钛铁矿等。
磷酸盐
磷酸盐有三类:正盐(含
三类盐之间的关系为:
(1)溶解性
正盐和一氢盐:除钾、钠、铵等少数盐外,其余都难溶于水,但能溶于强酸。
二氢盐:都易溶于水。
(2)相互转化
向磷酸中滴加碱液,随着碱液的增多,先后生成磷酸二氢盐、磷酸一氢盐、磷酸盐。
向磷酸盐溶液中滴加强酸,随着酸的增多,先后生成磷酸一氢盐、磷酸二氢盐、磷酸。
(3)离子共存的问题
①
②
③
④
检验
磷酸盐与过量钼酸铵在浓硝酸溶液中反应有淡黄色磷钼酸铵晶体析出,这是鉴定磷酸根离子的特征反应:
1、急性毒性
LD50:1530mg/kg(大鼠经口);2740mg/kg(兔经皮)
2、刺激性
家兔经皮:595mg(24h),重度刺激。
家兔经眼:119mg,重度刺激。
3、亚急性与慢性毒性
动物长期吸入10.6mg/m3,使血清蛋白含量增加及肝糖原降低。
4、生态毒性
TLm:138mg/L(96h)(食蚊鱼)
农业:磷酸是生产重要的磷肥(过磷酸钙、磷酸二氢钾等)的原料,也是生产饲料营养剂(磷酸二氢钙)的原料。
工业:磷酸是一种重要的化工原料,主要作用如下:
1、处理金属表面,在金属表面生成难溶的磷酸盐薄膜,以保护金属免受腐蚀。
2、和硝酸混合作为化学抛光剂,用以提高金属表面的光洁度。
3、生产洗涤用品、杀虫剂的原料磷酸酯。
4、生产含磷阻燃剂的原料。
食品:磷酸是食品添加剂之一,在食品中作为酸味剂、酵母营养剂,可乐中就含有磷酸。磷酸盐也是重要的食品添加剂,可作为营养增强剂。
GB 3149—92方法
混合指示剂 取0.1%百里酚蓝溶液3份和0.1%酚酞溶液2份,混合均匀。
1、重量法
亦称仲裁法,取试样5g(称准至0.0002g)放于100mL烧杯中,加10mL盐酸,盖上表面皿,煮沸10min,冷却后转入500mL容量瓶中,加10mL盐酸,用水定容后,摇匀。取该溶液50mL放于500mL容量瓶中,再用水定容后,摇匀,是为试样液。取试样液20mL放于400mL烧杯中,用水稀释至100mL,加喹钼柠酮试液(TS-202)50mL,盖上表面皿,在电热板上加热至杯内温度达75℃±5℃,保持半分钟或在水浴中保温至溶液分层(不能用明火加热,不论在加试剂或加热时都不能搅拌混匀,以免形成块状物),冷却过程中转动3~4次。用预先在175~185℃(或240~260℃)恒重的4号玻璃坩埚过滤,先将上层清液过滤,沉淀用倾泻法洗涤3~4次,每次约用水20mL,洗液通过坩埚过滤,然后将沉淀转到玻璃坩埚中,继续用水洗涤5~6次,置坩埚于175~185℃:烘箱中烘45min(或240~260℃烘箱中烘15min),玻璃坩埚于干燥器中冷却至室温称重。同测定手续,进行空白试验。
磷酸含量按下式计算:
H3PO4(%)=0.04428×(G2-G1)/G×50/500×20/500×100式中G一所取试样量,g
G2——测定样品时所得的沉淀量,g;
G1——空白测得的沉淀重量,g;
0.04428——每克磷钼酸喹啉相当于磷酸的质量,g。
2、容量法
按上述重量法测定手续进行至“冷却过程中转动3~4次”,以下操作按下述测定手续进行。用铺有滤纸、脱脂棉或纸浆的过滤器过滤,先将上层清液过滤,沉淀用倾泻法洗涤3~4次,每次约用水25~30mL,然后将沉淀转到过滤器上,继续用水洗涤至无酸性(取约20mL洗出液,加一滴混合指示剂和1滴0. 25mol/L的氢氧化钠液,所呈颜色与处理同体积水所呈的颜色相近为止)。将沉淀转入原烧杯中,加不含二氧化碳的水100mL,搅匀沉淀,约加0.5ml/L氢氧化钠标准液10mL,充分搅拌至沉淀溶解,加5滴混合指示剂,用0.25mol/L盐酸标准液滴定,溶液由紫色变为微黄色时为终点。
用同样测定手续,进行空白试验。
磷酸含量按下式计算:
H3PO4(%)=c(V1-V2)×0.003769/G×50/500×20/500×100
式中c——氢氧化钠标准溶液浓度,mol/L;
V1——试样所耗氢氧化钠标准溶液的体积,mL;
V2——试样所耗盐酸标准溶液的体积,mL;
V——在空白试验中,1mL盐酸标准溶液相当的氢氧化钠标准溶液体积,mL;
0.003769——毫摩尔磷酸的质量,g;
G一所取试样量,g。
本方法平行测定时允许误差在0~2%以内。
FAO/WHO滴定法 取试样1.00g放入一具玻塞烧瓶中,加水约100mL,再加百里酚酞试液(TS-248)0.5mL,用1mol/L氢氧化钠液滴定,每mL相当于H3PO4 0.049g。
安全术语
S1/2:Keep locked up and out of reach of children.
上锁保管并避免儿童触及。
S7:Keep container tightly closed.
保存在严格密闭容器中。
S16:Keep away from sources of ignition - NO smoking.
远离火源,禁止吸烟。
S24/25:Avoid contaCT with skin and eyes.
避免皮肤和眼睛接触。
S26:In case of contact with eyes, rinse immediately with plenty of water and seek medical advice.
眼睛接触后,立即用大量水冲洗并征求医生意见。
S36/37/39:Wear suitable protECTive clothing, gloves and eye/face protection.
穿戴适当的防护服、手套和眼睛/面保护。
S45:In case of accident or if you feel unwell, seek medical advice immediately (show the lable where possible).
发生事故时或感觉不适时,立即求医(可能时出示标签)。
风险术语
R34:Causes burns.
引起灼伤。