-
二氧化氮 编辑
中文名:二氧化氮
外文名:nitrogendioxide
化学式:NO₂
分子量:46.01
CAS登录号:10102-44-0
EINECS登录号:233-272-6
熔点:-11℃
沸点:21℃
密度:2.05kg/m³(气体)
外观:室温下为有刺激性气味的红棕色气体
闪点:无意义
应用:制备硝酸;用作氧化剂
安全性描述:S9;S26;S28;S36/37/39;S45
危险性描述:R26;R34
UN危险货物编号:1067
发现者:约瑟夫·普雷斯特利
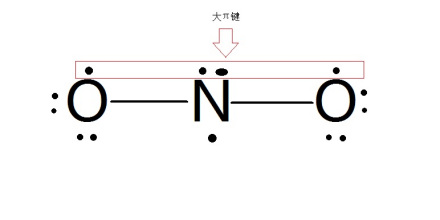
判断NO2分子的结构
在NO2分子中,N周围的价电子数为5,根据价层电子对互斥理论(VSEPR理论),氧原子不提供电子,因此,中心氮原子的价电子总数为5,相当于三对电子对.。其中有两对是成键电子对,一个成单电子当作一对孤电子对。氮原子价层电子对排布应为平面三角形。所以,NO2分子的结构为V字形,O-N-O键角约为120度。
当温度高于150℃时开始分解,到650℃时完全分解为一氧化氮和氧气。与水反应生成硝酸和一氧化氮;与浓硫酸反应生成亚硝基硫酸,与碱反应生成等摩尔硝酸盐和亚硝酸盐。二氧化氮在气相状态下有叠合作用,生成四氧化二氮,它总是与四氧化二氮在一起呈平衡状态存在。
二氧化氮(NO2)在21.1℃温度时为棕红色刺鼻气体。常温下化学性质较稳定。
自身的化合
二氧化氮加压时很容易聚合。通常情况下与其二聚体形式四氧化二氮(无色抗磁性气体)混合存在,构成一种平衡态混合物:二氧化氮转化成四氧化二氮放热。升高温度,平衡向二氧化氮生成的方向移动;降低温度,平衡向四氧化二氮生成的方向移动。
和水的反应
二氧化氮溶于水并与水反应生成硝酸或硝酸和一氧化氮。但二氧化氮溶于水后并不会完全反应所以会有少量二氧化氮分子存在,为黄色。由于硝酸同时会分解,所以可以看作可逆反应。因二氧化氮溶于水后还生成一氧化氮,所以不是硝酸的酸酐。
氧化性
二氧化氮中氮元素化合价为+4,有氧化性。
二氧化氮可以和氧气一样支持某些金属和非金属的燃烧:(现象:固体在红棕色气体中继续燃烧,发出耀眼的光芒,气体的红棕色逐渐褪去)
例如与氨气反应:
二氧化氮除自然来源外,主要来自于燃料的燃烧、城市汽车尾气。此外,工业生产过程也可产生一些二氧化氮。据估计,全世界人为污染每年排出的氮氧化物大约为5300万吨。
另外闪电也可以产生NO2,在闪电时由于空气中电场极强,空气中的一些物质的分子被撕裂而导电,雷电电流通过时产生大量的热,使已经呈游离状态的空气成分N2、O2结合。
二氧化氮在化学反应和火箭燃料中用作氧化剂,在亚硝基法生产硫酸中用作催化剂,在工业上可以用来制作硝酸。
健康危害
侵入途径:吸入。
健康危害:氮氧化物主要损害呼吸道。吸入初期仅有轻微的眼及上呼吸道刺激症状,如咽部不适、干咳等。常经数小时至十几小时或更长时间潜伏期后发生迟发性肺水肿、成人呼吸窘迫综合症,出现胸闷、呼吸窘迫、咳嗽、咯泡沫痰、紫绀等。可并发气胸及纵隔气肿。肺水肿消退后两周左右可出现迟发性阻塞性细支气管炎。
慢性影响:主要表现为神经衰弱综合征及慢性呼吸道炎症。个别病例出现肺纤维化。可引起牙齿酸蚀症。
毒理学资料及环境行为
急性毒性:LC50:126mg/m3,4小时(大鼠吸入)
致突变性:微生物致突变:鼠伤寒沙门氏菌6ppm。哺乳动物体细胞突变:大鼠吸入15ppm(3小时),连续。
生殖毒性:大鼠吸入最低中毒浓度(TCLo):8.5µg/m3,24小时(孕1-22天),引起胚胎毒性和死胎。
危险特性:本品不燃烧,但可助燃。具有强氧化性,遇衣物、锯末、棉花或其它可燃物能立即燃烧。与一般燃料或火箭燃料以及氯代烃等猛烈反应引起爆炸。遇水有腐蚀性,腐蚀作用随水分含量增加而加剧。
燃烧(分解)产物:氮氧化物。
急救措施
皮肤接触:脱去污染的衣着,用流动清水冲洗。
眼睛接触:立即提起眼睑,用流动清水冲洗。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
食入:饮足量温水,催吐,就医。
呼吸系统防护:空气中浓度超标时,佩戴自吸过滤式防毒面具(全面罩)。紧急事态抢救或撤离时,建议佩戴空气呼吸器。
眼睛防护:呼吸系统防护中已作防护。
身体防护:穿胶布防毒衣。
手防护:戴橡胶手套。
其他:工作现场禁止吸烟、进食和饮水。保持良好的卫生习惯。进入罐、限制性空间或其它高浓度区作业,须有人监护。
迅速撤离泄漏污染区人员至上风处,并进行隔离,严格限制出入。建议应急处理人员戴自给正压式呼吸器,穿防毒服。尽可能切断泄漏源。若是气体,合理通风,加速扩散。喷雾状水稀释、溶解。构筑围堤或挖坑收容产生的大量废水。漏气容器要妥善处理,修复、检验后再用。若是液体,用大量水冲洗,洗水稀释后放入废水系统。若大量泄漏,构筑围堤或挖坑收容;喷雾状水冷却和稀释蒸气。用防爆泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
消防措施
灭火方法:不燃。消防人员必须佩戴过滤式防毒面具(全面罩)或隔离式呼吸器、穿全身防火防毒服。在上风处灭火。切断气源。喷水冷却容器,可能的话将容器从火场移至空旷处。
灭火剂:干粉、二氧化碳、禁止用水、卤代烃灭火剂灭火。
操作注意事项:严加密闭,提供充分的局部排风和全面通风。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防毒面具(全面罩),穿胶布防毒衣,戴橡胶手套。远离火种、热源,工作场所严禁吸烟。远离易燃、可燃物。防止气体或蒸气泄漏到工作场所空气中。避免与还原剂接触。搬运时轻装轻卸,防止钢瓶及附件破损。配备相应品种和数量的消防器材及泄漏应急处理设备。
储存注意事项:储存于阴凉、通风的库房。远离火种、热源。库温不宜超过15℃。应与易(可)燃物、还原剂、食用化学品分开存放,切忌混储。储区应备有泄漏应急处理设备。
运输注意事项:采用钢瓶运输时必须戴好钢瓶上的安全帽。钢瓶一般平放,并应将瓶口朝同一方向,不可交叉;高度不得超过车辆的防护栏板,并用三角木垫卡牢,防止滚动。严禁与易燃物或可燃物、还原剂、食用化学品等混装混运。夏季应早晚运输,防止日光曝晒。公路运输时要按规定路线行驶,禁止在居民区和人口稠密区停留。铁路运输时要禁止溜放。