-
组蛋白 编辑
组蛋白(histone)是指所有真核生物的细胞核中,与DNA结合存在的碱性蛋白质的总称。其分子量约10000~20000KDA。
真核生物体细胞染色质中的碱性蛋白质,含精氨酸和赖氨酸等碱性氨基酸特别多,二者加起来约为所有氨基酸残基的1/4。组蛋白与带负电荷的双螺旋DNA结合成DNA-组蛋白复合物。因氨基酸成分和分子量不同,主要分成5类。
组蛋白的甲基化修饰主要是由一类含有SET结构域的蛋白质来执行的,组蛋白甲基化修饰参与异染色质形成、基因印记、x染色体失活和转录调控等多种主要生理功能,组蛋白的修饰作用是表观遗传学研究的一个重要领域。组蛋白甲基化的异常与肿瘤发生等多种人类疾病相关,可以特异性地激活或者抑制基因的转录活性。研究发现,组蛋白甲基转移酶的作用对象不仅仅限于组蛋白,某些非组蛋白也可以被组蛋白甲基转移酶甲基化,这将为探明细胞内部基因转录、信号转导、甚至个体的发育和分化机制提供更广阔的空间。
组蛋白的基因非常保守。亲缘关系较远的种属中,四种组蛋白(H2A、H2B、H3、H4)氨基酸序列都非常相似,如海胆组织H3的氨基酸序列与来自小牛胸腺的H3的氨基酸序列间只有一个氨基酸的差异,小牛胸腺的H3的氨基酸序列与豌豆的H3也只有4个氨基酸不同。不同生物的H1序列变化较大,在某些组织中,H1被特殊的组蛋白所取代。如成熟的鱼类和鸟类的红细胞中H1则被H5所取代,精细胞中则由精蛋白代替组蛋白。染色质中的组蛋白与DNA的含量之比为1:1。真核生物细胞核中组蛋白的含量约为每克DNA 1克,大部分真核生物中有5种组蛋白,两栖类、鱼类和鸟类还有H5以替代或补充H1。染色质是由许多核小体组成的,H2A,H2B,H3和H4各2个分子构成的8聚体是核小体的核心部分,H1的作用是与线性 DNA结合以帮助后者形成高级结构。组蛋白是已知蛋白质中最保守的,例如,人类和豌豆的H4氨基酸序列只有两个不同,人类和酵母的H4氨基酸序列也只有8个不同,这说明H4的氨基酸序列在约10^9年间几乎是恒定的。
1884年,艾布瑞契·科塞尔首先发现组蛋白。 直至1990年代早期,组蛋白才被更多认识,并非纯粹细胞核的惰性填充料,这部分基于马克·普塔什尼(Mark Ptashne)等人的模型,他们认为转录是被蛋白质-DNA和蛋白质-蛋白质相互作用在很大程度上被激活裸DNA模板,就像细菌一样。及后它的调控功能才被发现。
在1980年代,Yahli Lorch和罗杰·科恩伯格(Roger Kornberg)表明,核心启动子上的核小体体外阻止了转录的启动,迈克尔·格伦斯坦(Michael Grunstein)证明组蛋白在体内抑制转录,导致核小体为 一般基因阻遏物。
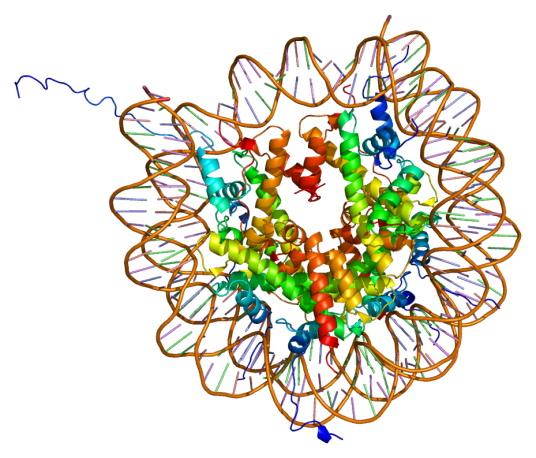
通常含有H1,H2A,H2B,H3,H4等5种成分。除H1外,其他4种组蛋白均分别以二聚体(共八聚体)相结合,形成核小体核心。DNA便缠绕在核小体的核心上。而H1则与核小体间的DNA结合。因此,一般认为组蛋白作为结构支持体的作用比其基因调节作用更为重要。鸟类、两栖类等含有细胞核的红细胞中,含有一种叫H5的特殊组蛋白。此外,在停止增殖的细胞中,还含有一种叫H1°的组蛋白,H1°的结构与H5相类似。组蛋白可受到甲基化、乙酰化、磷酸化、聚ADP核糖酰化,以及与泛醌(ubiquiNOne)相结合等几种类型的修饰。组蛋白的修饰与染色质结构的变化及基因活性控制的相关性等等,是今后的重要研究课题。
种类 | 赖氨酸/精氨酸 | 残基数 | 分子质量(kd) | 存在部位及结构作用 | |
H1 | 29.0 | 215 | 23.0 | 低 | 连接线上,锁定核小体、参与包装 |
H2A | 1.22 | 129 | 14.0 | 高 | 核心颗粒,形成核小体 |
H2B | 2.66 | 125 | 13.8 | 高 | 核心颗粒,形成核小体 |
H3 | 0.77 | 135 | 15.3 | 极高 | 核心颗粒,形成核小体 |
H4 | 0.79 | 102 | 11.3 | 极高 | 核心颗粒,形成核小体 |
H1富含碱性氨基酸
填充蛋白质
组蛋白作为DNA缠绕的线轴。 这使得能够在细胞核内将真核细胞的大型的基因组所必需的压实物:压实的分子比未压实的分子短40,000倍。
染色质调控
组织蛋白进行翻译后修饰,以更改它与DNA及其他核蛋白的相互作用。组织蛋白H3及H4有着核小体伸出的长尾巴,能够在不同的地方进行共价修饰。这种修饰包括有甲基化、瓜氨化、乙酰基化、磷酸化、小泛素相关修饰化、泛素化及二磷酸腺苷核糖基化。组织蛋白核心(即H2A及H3)亦可以作出修饰。修饰的组合可以组成编码,成为组织蛋白编码。组织蛋白修饰在不同的生物过程起着作用,包括基因表观调控、DNA修复、有丝分裂及减数分裂。
组织蛋白修饰的命名是:
先以组蛋白名称开始,如H3;单一字母的氨基酸简称,如K代表赖氨酸,及在蛋白质的位置;及修饰的种类,Me即甲基化、P即磷酸化、Ac即乙酰化及Ub即泛素化。
预测
最新研究结果显示:组蛋白修饰的整体模式可预测低分级前列腺癌的复发风险。该研究第一作者加利福尼亚大学的Siavash K. Kurdistani表示:这种修饰模式最终可作为前列腺或其他类型癌症的预后或诊断指标,也可作为预测何种患者、患者会对一类o组蛋白去乙酰酶抑制剂新药产生反应的指标。Kurdistani解释:某些组蛋白修饰模式会在一定水平上影响基因的表达,但具体机制尚不清楚。
调控
组蛋白修饰与基因表达调控有关已经被广泛的证明了。PierreEtchegary,StevenReppERTandcoworkers的研究表明组蛋白修饰,特别是组蛋白乙酰化对于哺乳动物生物钟的调控是非常重要的。
调控生物钟的关键蛋白Clock和Bmal1驱动着三个period基因(Per1,2,3)和两个细胞色素基因(Cry1,2)的表达。这5个基因的转录本覆盖了生物24小时的时间。但奇怪的是Clock/Bmal1对Per启动子的结合相对稳定,而它们对Cry1启动子最强的结合却反应着Cry1表达的最弱。在这篇文章中E发现是染色体结构的修饰来决定Per和Cry基因的转录的。
研究者发现在Per1和Per2的启动子上组蛋白3的乙酰化在全天都存在,而RNA多聚酶Ⅱ也一直被招募在这些启动子上。当H3被乙酰化和RNA多聚酶Ⅱ结合最强时,Per转录本水平最高,这说明H3的乙酰化可能通过促进将RNA多聚酶Ⅱ招募到启动子上而促进基因的转录。Cry基因座位的表达也有类似的相关性。
研究者发现具有蛋白质乙酰化活性的p300在小鼠肝细胞中能与Clock组成复合物。研究者认为白天p300/Bmal1/Clock结合在启动子上,促进H3乙酰化,RNA多聚酶Ⅱ招募到启动子上而Per基因发生转录。夜间p300与Bmal1/Clock进行解离,导致组蛋白的去乙酰化而抑制基因的转录。
那么,导致p300基因日夜节律的是什么呢?
研究者发现是Cry对其进行负调控的结果,研究者发现Cry1,2抑制p300/Bmal1/Clock驱动的基因转录。他们认为可能是Cry对p300/Bmal1/Clock复合物进行去稳定性作用而对其功能进行抑制。乙酰化对基因表达的调控已经广为人知,这个新的研究更让人们确定组蛋白的乙酰化对基因表达的调控具有很广泛的作用。