-
氨基酸代谢 编辑
氨基酸代谢(amino acid metabolism)
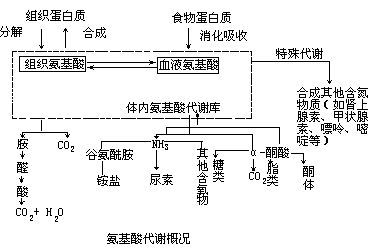
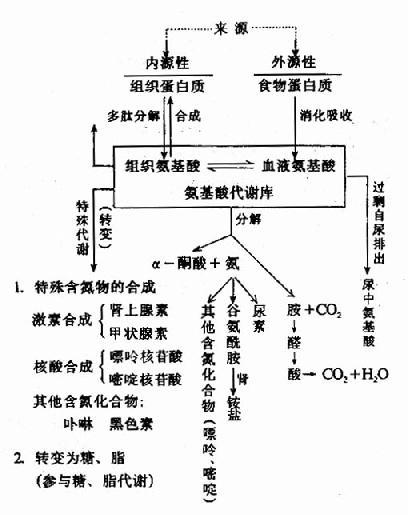
人和动物由食物引入的蛋白质或是组成机体细胞的蛋白质和在细胞内合成的蛋白质,都必须先在酶的参与下加水分解后才进行代谢。植物与微生物的营养类型与动物不同,一般并不直接利用蛋白质作为营养物,但其细胞内的蛋白质在代谢时仍然需要先行水解。分解代谢过程中生成的氨,在不同动物体内可以以氨、尿素或尿酸等形式排出体外。某些氨基酸可以通过特殊代谢途径转变成其他含氮物质如嘌呤、嘧啶、卟啉、某些激素、色素、生物碱等。体内某些氨基酸在代谢过程中还可以相互转变。①蛋白质的营养作用:蛋白质的生理功能,营养必需氢基酸,蛋白质的营养互补作用。
②氨基酸的一般代谢:氨基酸的脱氨基作用,α-酮酸的代谢,氨的代谢。
氨基酸的分解代谢主要在肝脏中进行。
氨基酸的分解代谢一般是先脱去氨基,形成的碳骨架可以被氧化成CO2和H2O,产生ATP ,也可以为糖、脂肪酸的合成提供碳架。
氧化脱氨基
第一步,脱氢,生成亚胺。
第二步,水解。生成的H2O2有毒,在过氧化氢酶催化下,生成H2O+O2↑,解除对细胞的毒害。
(1)、L—氨基酸氧化酶
有两类辅酶,E—FMN
E—FAD(人和动物)
对下列a.a不起作用:
Gly、β-羟氨酸(Ser、 Thr)、二羧a.a( Glu、 Asp)、二氨a.a (Lys、 Arg)
真核生物中,真正起作用的不是L-a.a氧化酶,而是谷氨酸脱氢酶。
(2)、D-氨基酸氧化酶 E-FAD
有些细菌、霉菌和动物肝、肾细胞中有此酶,可催化D-a.a脱氨。
(3)、Gly氧化酶 E-FAD使Gly脱氨生成乙醛酸。(4)、D-Asp氧化酶E-FAD
E-FAD 兔肾中有D-Asp氧化酶,D-Asp脱氨,生成草酰乙酸。
(5)、L-Glu脱氢酶 E-NAD+ E-NADP+ P220 反应式:
真核细胞的Glu脱氢酶,大部分存在于线粒体基质中,是一种不需O2的脱氢酶。
此酶是能使a.a直接脱去氨基的活力最强的酶,是一个结构很复杂的别构酶。在动、植、微生物体内都有。
ADP、GDP及某些a.a可激活此酶活性。
因此当ATP、GTP不足时,Glu的氧化脱氨会加速进行,有利于a.a分解供能(动物体内有10%的能量来自a.a氧化)。
非氧化脱氨基作用
(大多数在微生物的中进行)
①还原脱氨基(严格无氧条件下)
②水解脱氨基
③脱水脱氨基
④脱巯基脱氨基
⑤氧化-还原脱氨基
⑥脱酰胺基作用
谷胺酰胺酶:谷胺酰胺+ H2O →谷氨酸+ NH3
天冬酰胺酶:天冬酰胺 + H2O → 天冬氨酸 + NH3
谷胺酰胺酶、天冬酰胺酶广泛存在于动植物和微生物中
转氨基作用
转氨作用是a.a脱氨的重要方式,除Gly、Lys、Thr、Pro外,a.a都能参与转氨基作用。
转氨基作用由转氨酶催化,辅酶是维生素B6(磷酸吡哆醛、磷酸吡哆胺)。转氨酶在真核细胞的胞质、线粒体中都存在。转氨基作用:是α-氨基酸和α-酮酸之间氨基转移作用,结果是原来的a.a生成相应的酮酸,而原来的酮酸生成相应的氨基酸。
不同的转氨酶催化不同的转氨反应。
大多数转氨酶,优先利用α-酮戊二酸作为氨基的受体,生成Glu。如丙氨酸转氨酶,可生成Glu,叫谷丙转氨酶(GPT)。肝细胞受损后,血中此酶含量大增,活性高。肝细胞正常,血中此酶含量很低。
动物组织中,Asp转氨酶的活性最大。在大多数细胞中含量高,Asp是合成尿素时氮的供体,通过转氨作用解决氨的去向。
联合脱氨基
单靠转氨基作用不能最终脱掉氨基,单靠氧化脱氨基作用也不能满足机体脱氨基的需要,因为只有Glu脱氢酶活力最高,其余L-氨基酸氧化酶的活力都低。
机体借助联合脱氨基作用可以迅速脱去氨基 。
1、以谷氨酸脱氢酶为中心的联合脱氨基作用
氨基酸的α-氨基先转到α-酮戊二酸上,生成相应的α-酮酸和Glu,然后在L-Glu脱氨酶催化下,脱氨基生成α-酮戊二酸,并释放出氨。以谷氨酸脱氢酶为中心的联合脱氨基作用
2、通过嘌呤核苷酸循环的联合脱氨基做用
P 225结构式:次黄嘌呤核苷一磷酸(IMP)、腺苷酸代琥珀酸、腺苷酸
P226 图16-4通过嘌呤核苷酸循环的联合脱氨基做用
生物体内大部分a.a可进行脱羧作用,生成相应的一级胺。
a.a脱羧酶专一性很强,每一种a.a都有一种脱羧酶,辅酶都是磷酸吡哆醛。
a.a脱羧反应广泛存在于动、植物和微生物中,有些产物具有重要生理功能,如脑组织中L-Glu脱羧生成r-氨基丁酸,是重要的神经介质。His脱羧生成组胺(又称组织胺),有降低血压的作用。Tyr脱羧生成酪胺,有升高血压的作用。
但大多数胺类对动物有毒,体内有胺氧化酶,能将胺氧化为醛和氨。
氨对生物机体有毒,特别是高等动物的脑对氨极敏感,血中1%的氨会引起中枢神经中毒,因此,脱去的氨必须排出体外。
氨中毒的机理:脑细胞的线粒体可将氨与α-酮戊二酸作用生成Glu,大量消耗α-酮戊二酸,影响TCA,同时大量消耗NADPH,产生肝昏迷。
氨的去向:
(1)重新利用 合成a.a、核酸。
(2)贮存 Gln,Asn
(3)排出体外
排氨动物:水生、海洋动物,以氨的形式排出。
排尿酸动物:鸟类、爬虫类,以尿酸形式排出。
排尿动物:以尿素形式排出。
氨的转运
(肝外→肝脏)
1、Gln转运 Gln合成酶、Gln酶(在肝中分解Gln)
Gln合成酶,催化Glu与氨结合,生成Gln。
Gln中性无毒,易透过细胞膜,是氨的主要运输形式。
Gln经血液进入肝中,经Gln酶分解,生成Glu和NH3。
2、丙氨酸转运(Glc-Ala循环)
肌肉可利用Ala将氨运至肝脏,这一过程称Glc-Ala循环。
丙氨酸在PH7时接近中性,不带电荷,经血液运到肝脏
肌肉运动产生大量的氨和丙酮酸,两者都要运回肝脏,而以Ala的形式运送,一举两得。
氨的排泄
1、直接排氨
排氨动物将氨以Gln形式运至排泄部位,经Gln酶分解,直接释放NH3。游离的NH3借助扩散作用直接排除体外。
2、尿素的生成(尿素循环)
排尿素动物在肝脏中合成尿素的过程称尿素循环
1932年,Krebs发现,向悬浮有肝切片的缓冲液中,加入鸟氨酸、瓜氨酸、Arg中的任一种,都可促使尿素的合成。
尿素循环途径(鸟氨酸循环):
(1)、氨甲酰磷酸的生成(氨甲酰磷酸合酶I)
肝细胞液中的a.a经转氨作用,与α-酮戊二酸生成Glu,Glu进入线粒体基质,经Glu脱氢酶作用脱下氨基,游离的氨(NH4+)与TCA循环产生的CO2反应生成氨甲酰磷酸。
氨甲酰磷酸合酶I:存在于线粒体中,参与尿素的合成。
氨甲酰磷酸合酶II:存在于胞质中,参与尿嘧啶的合成。
N-乙酰Glu激活氨甲酰磷酸合酶I、II
(2)、合成瓜氨酸(鸟氨酸转氨甲酰酶)
鸟氨酸接受氨甲酰磷酸提供的氨甲酰基,生成瓜氨酸。
鸟氨酸转氨甲酰酶存在于线粒体中,需要Mg2+作为辅因子。
瓜氨酸形成后就离开线粒体,进入细胞液。
(3)、合成精氨琥珀酸(精氨琥珀酸合酶)
(4)、精氨琥珀酸裂解成精氨酸和延胡索酸(精氨琥珀酸裂解酶)
精氨琥珀酸 →精氨酸+延胡索酸
此时Asp的氨基转移到Arg上。
来自Asp的碳架被保留下来,生成延胡索酸。延胡索酸可以经苹果酸、草酰乙酸再生为天冬氨酸,
(5)、精氨酸水解生成鸟氨酸和尿素
尿素形成后由血液运到肾脏随尿排除。
尿素循环总反应:
NH4+ + CO2 + 3ATP + Asp + 2H2O →尿素+ 2ADP + 2Pi + AMP + Ppi + 延胡索酸
形成一分子尿素可清除2分子氨及一分子CO2 , 消耗4个高能磷酸键。
联合脱-NH2合成尿素是解决-NH2去向的主要途径。
尿素循环与TCA的关系:草酰乙酸、延胡索酸(联系物)。
肝昏迷(血氨升高,使α-酮戊二酸下降,TCA受阻)可加Asp或Arg缓解。
生成尿酸
(见核苷酸代谢)
尿酸(包括尿素)也是嘌呤代谢的终产物。
20种aa有三种去路
(1)氨基化还原成氨基酸。
(2)氧化成CO2和水(TCA)。
(3)生糖、生脂。
20种a.a的碳架可转化成7种物质:丙酮酸、乙酰CoA、乙酰乙酰CoA、α-酮戊二酸、琥珀酰CoA、延胡索酸、草酰乙酸。
它们最后集中为5种物质进入TCA:乙酰CoA、α-酮戊二酸、琥珀酰CoA、延胡索酸、草酰乙酸。
氨基酸碳骨架进入TCA的途径
转变1
Ala、Gly、Ser、Thr、Cys形成丙酮酸的途径
(1)、Ala 经与α-酮戊二酸转氨(谷丙转氨酶)
(2)、Gly先转变成Ser,再由Ser转变成丙酮酸。
Gly与Ser的互变是极为灵活的,该反应也是Ser生物合成的重要途径。
Gly的分解代谢不是以形成乙酰CoA为主要途径,Gly的重要作用是一碳单位的提供者。
Gly + FH4 + NAD+ → N5,N10-甲烯基FH4 + CO2 + NH4+ + NADH
(3)、Ser 脱水、脱氢,生成丙酮酸(丝氨酸脱水酶)
(4)、Thr 有3条途径
①转氨,生成β-巯基丙酮酸,再脱巯基,生成丙酮酸。
②氧化成丙酮酸
③加水分解成丙酮酸
转变2
(1)、Phe → Tyr → 乙酰乙酰CoA Phe、Tyr分解为乙酰乙酰CoA和延胡索酸的途径
(2)、Tyr
产物:1个乙酰乙酰CoA(可转化成2个乙酰CoA。),1个延胡索酸,1个CO2 ,
(3)、Leu
产物:1个乙酰CoA,1个乙酰乙酰CoA,相当于3个乙酰CoA。
反应中先脱1个CO2 ,后又加1个CO2 ,C原子不变 。
(4)、Lys
产物:1个乙酰乙酰CoA,2个CO2 。
在反应途中转氨:a. 氧化脱氨 , b. 转氨
(5)、Trp P
产物:1个乙酰乙酰CoA,1个乙酰CoA,4个CO2 ,1个甲酸。
转变3
Arg、His、Gln、Pro、Glu形成α-酮戊二酸的途径
(1)、Arg
产物:1分子Glu,1分子尿素
(2)、His
产物:1分子Glu,1分子NH3 ,1分子甲亚氨基
(3)、Gln 三条途径
①.Gln酶: Gln + H2O → Glu + NH3
②.Glu合成酶: . Gln+α-酮戊二酸 + NADPH → 2Glu + NADP+
③.转酰胺酶:Gln+α-酮戊二酸 → Glu + r-酮谷酰氨酸 → α-酮戊二酸 + NH4+
(4)、Pro
产物:Pro → Glu
Hpro → 丙酮酸 + 丙醛酸
琥珀酰CoA途径
Met、Ile、Val转变成琥珀酰CoA
(1)、Met
给出1个甲基,将-SH转给Ser(生成Cys),产生一个琥珀酰CoA
(2)、Ile
产生一个乙酰CoA和一个琥珀酰CoA
(3)、Val
草酰乙酸途径
Asp和Asn可转变成草酰乙酸进入TCA,Asn先转变成Asp(Asn酶),Asp经转氨作用生成草酰乙酸.
延胡索酸途径
Phe、Tyr可生成延胡索酸
Phe、Tyr、Leu、Lys、Trp。在分解过程中转变为乙酰乙酰CoA,后者在动物肝脏中可生成乙酰乙酸和β-羟丁酸,因此这5种a.a.称生酮a.a.