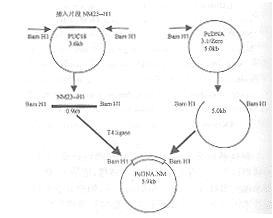
-
抑制基因 编辑
分为针对错义突变型的、移码突变型的和针对无义突变型的等几种。
针对错义突变的基因内抑制
一个错义突变型的表型可由同一基因另一位置上发生错义突变而恢复正常。例如大肠杆菌的色氨酸合成酶 A亚基基因的错义突变型A46是一个碱基置换突变 (GGA→GAA)。这一置换突变使A亚基的第210个氨基酸──甘氨酸为谷氨酸所替代,从而使它失去了正常的酶活性。在这一替代不改变的情况下,另一错义突变 A446(UAC→UGC)使A亚基的第174个氨基酸──酪氨酸为半胱氨酸所替代,这一改变导致酶活性的恢复。这是针对碱基置换突变的基因内抑制,抑制基因本身也常是错义突变型。
针对移码突变的基因内抑制
大肠杆菌噬菌体T4经吖啶类染料处理后可以得到一对核苷酸减少(或增加)的rⅡ基因的移码突变型。 在这一对核苷酸不改变的情况下,附近位置上另一对核苷酸的增加(或减少)能使表型恢复正常(见遗传密码),这便是针对移码突变的基因内抑制,抑制基因本身也常是移码突变型。
针对无义突变的基因内抑制
密码子AAG代表赖氨酸,由于置换突变而成为无义密码子UAG时,翻译便到此停止而带来突变型表型。在第一对核苷酸不改变的情况下,由于第三对核苷酸的改变而使密码子成为UAC时,便在这位置上出现酪氨酸并使翻译正常进行。只要由赖氨酸改变为酪氨酸不影响这一基因产物的活性,表型便得以恢复。这是针对无义突变的基因内抑制。
通过翻译校正的基因间抑制 某些由置换突变产生的无义突变型,可以由于相应的突变型转运核糖核酸(tRNA)的校正作用而恢复正常的表型。例如酪氨酸密码子是UAC,酪氨酸tRNA反密码子是AUG。置换突变使UAC变为无义密码子 UAG后翻译便到此停止。如果酪氨酸tRNA基因发生突变而使它的反密码子由AUG变为AUC,这一反密码子便能识别无义密码子UAG,可是它的3′端上仍然携带着酪氨酸。因此这一突变型tRNA能使无义突变密码子位置上照常出现酪氨酸而使翻译正常进行。这里酪氨酸tRNA的突变基因便是前一无义突变型的抑制基因。
实际上任何一个突变型只要它和野生型只有一对核苷酸的差别,都可以由相应的tRNA基因突变型的校正作用而恢复野生型表型。
抑制基因的专一性和表型效应
各种抑制基因的作用可以有不同的专一性。 果蝇的毛翅抑制基因Su-Hw除了抑制毛翅以外,对于分叉刚毛(bifid,bi),翅脉中断(cubitus interruptus,ciD) 也有一定程度的抑制作用;星眼抑制基因则只对星眼突变(star,S)有抑制作用。脉孢菌的紫色腺嘌呤缺陷型的抑制基因只抑制该突变型的紫色表型而不抑制对于腺嘌呤的需要这一表型。琥珀突变型抑制基因的抑制作用针对无义密码子UAG,而不论这一无义突变发生在哪一基因中,所以它又称为超抑制基因。相反地,许多抑制基因的作用是座位专一的,它能抑制某一突变基因的表型,不论突变发生在这基因的哪一位点。某些抑制基因的作用则是位点专一的,它对被抑制基因的抑制作用只限于某些位点上的突变。例如大肠杆菌的突变型 dnaAts是在高温中不能复制DNA的突变型。rpoB是它的抑制基因,每一个rpoB突变只抑制某一些位点发生突变的 dnaAts突变型,而不抑制同一基因的某些其他位点的突变型。一般认为位点专一性是由于抑制基因与被抑制基因所编码的两种蛋白质分子的相互作用只限于某些相对应的部位的缘故。某些抑制基因能够抑制许多突变基因的表型,例如琥珀突变型抑制基因。相反地,一个基因的表型也可以被几个不同的抑制基因所抑制,例如脉孢菌紫色腺嘌呤缺陷型至少有三个抑制基因。
某些抑制基因本身并没有表型效应,例如果蝇的毛翅抑制基因。某些抑制基因本身具有突变型表型效应,例如大肠杆菌的色氨酸合成酶A亚基基因的突变型A446对于另一个A亚基突变型A46是抑制基因,A46对A446来讲也是抑制基因。脉孢菌的紫色腺嘌呤缺陷型的几个抑制基因本身也都是腺嘌呤缺陷型。大肠杆菌中由于tRNA基因发生突变的抑制基因则虽然没有一般的突变型表型,可是普遍地降低生活力。
抑制基因或是隐性的,或是显性的。在细菌等单倍体生物中,不论抑制基因是隐性或显性,往往可以从被它抑制的突变型──假的回复体中发现。这些假的回复体和野生型杂交的子代中总是或多或少地出现原来的突变型;相反地,真的回复体和野生型杂交的子代中则不出现原来的突变型。在二倍体的高等生物中,按照子二代中出现野生型和突变型的比数便可以判断抑制基因的存在以及抑制基因的显隐性关系。
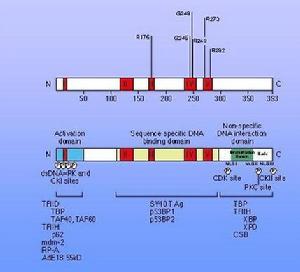
在细胞凋亡的相关调控基因的研究方面,Bcl-2基因是研究的最深入、最广泛的凋亡调控基因之一。Bcl-2基因最初是在非霍奇金滤泡状B细胞淋巴瘤中分离出来的,它是在14号与18号染色体易位的断点上被发现的。Bcl-2基因编码一个25-26KD的蛋白,其C端的21个疏水氨基酸组成一个延伸的链状结构。这个链可以插到细胞的膜结构中,这一结构特点与Bcl-2调节细胞凋亡的方式和能力非常有关。已经证实Bcl-2存在于线粒体外膜、核膜和内质网膜上。根据对Bcl-2家族成员蛋白的结构研究,发现其共同点是在蛋白链上都存在三个结构基序,分别称为BH1、BH2和BH3结构域。和Ced-9一样,Bcl-2基因属于一类新的癌基因家族成员,通过有效抑制许多不同类型细胞中许多不同类型的凋亡刺激诱导的细胞凋亡,延长细胞活力而发挥其生物学作用,对细胞周期的进程不发生影响。这说明它在细胞凋亡调控机制中起着十分重要的作用,可能是许多因子作用的共同分子基础。但是Bcl-2基因如何抑制细胞凋亡的机制尚不清楚。最近发现Bcl-2可与细胞中的bax蛋白质结合构成不同的二聚体(Bcl-2/ Bcl-2、Bcl-2/bax、bax/bax),通过它们之间的不同比例来调节细胞凋亡。用EB病毒来感染细胞后可使细胞发生永生或生存期延长,这是因为EB病毒促使Bcl-2表达的结果。应用原位杂交和免疫组化方法对鼻咽癌组织和体外培养的细胞进行研究发现,鼻咽癌组织及其体外培养细胞出现bcl-2的过表达。
Bcl-2基因家族是广泛研究的一类细胞凋亡相关基因,其表达和调控是影响细胞凋亡的关键因素之一,在细胞凋亡信号转导途径中发挥质量要作用。通过上调促凋亡的Bcl-2的基因表达,从而在转录水平调节凋亡相关蛋白的表达以影响凋亡的发生。Bcl-2家族成员都含有1-4个Bcl-2同源结构域(BH1-4),并且通常有一个羧端跨膜结构域。其中BH4是抗凋亡蛋白所特有的结构域,BH3是与促进凋亡有关的结构域。根据功能和结构可将Bcl-2基因家族分为两类,一类是抗凋亡的(anti-apoptotic),如:Bcl-2、Bcl-xl、Bcl-w、Mcl-1;一类是促进凋亡的(Pro-Apoptotic),如:Bax、Bak、Bad、Bid、Bim,在促凋亡蛋白中还有一类仅含BH3结构,如Bid、Bad。已经在哺乳动物、线虫和细菌中发现并鉴定出了bcl-2家族的20余种蛋白质,根据它们在细胞凋亡中的作用可分为两类:一类是抗凋亡蛋白,包括Bcl-2、Bcl-xL、Bcl-W、Mcl-l、AI、Boo和Ced-9等十余个成员;另一类是促凋亡蛋白,包括Bax、Bak、Bcl-xS、Bid、Bad和Egl-l等十余个成员。Bcl-2是迄今研究得最深入、最广泛的凋亡调控基因之一,编码产物Bcl-2蛋白可抑制细胞凋亡,参与细胞增殖与凋亡动态平衡的调控。