-
水溶性维生素 编辑
化学构造
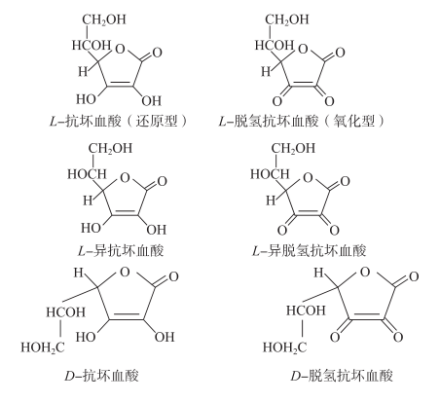
维生素C,又名抗坏血酸(ascorbicacid,AA),是一个多羟基羧酸的内酯,具有烯二醇结构。维生素C的C4和C5是手性碳原子,C4位上的羟基排列差异产生D-型和L-型两种立体异构体,C5位上的羟基排列差异产生抗坏血酸和异抗坏血酸两种立体异构体,抗坏血酸的双电子氧化和氢离子的解离反应使之转变为脱氢抗坏血酸(DHAA)。自然界存在的维生素C主要是L-异构体,D-异构体的含量很少,其中以L-抗坏血酸生物活性最高。D-异构体的生物活性只有L-异构体的10%,但抗氧化性能相同。L-异抗坏血酸具有与L-抗坏血酸相似的化学性质,但不具有维生素C的生物活性,在食品工业中也是广泛作为抗氧化剂使用,用来抑制水果和蔬菜的酶促褐变,L-脱氢抗坏血酸在体内可以完全还原为L-抗坏血酸,因此具有与L-抗坏血酸相同的生物活性。
特性
维生素C为白色或微黄色片状晶体或粉末,熔点190℃~192℃,极易溶于水,微溶于乙醇,不溶于有机溶剂,无臭,味酸。维生素C分子中C2和C3位上有2个烯醇式羟基,极易解离出氢离子,故维生素C具有酸性和较强的还原性。相对来说C3位上的羟基易电离(pKa1=4.04,25℃),C2位上的羟基较难电离(pKa2=11.4,25℃)。维生素C化学性质较活泼,是最不稳定的维生素,维生素C固体在干燥条件下比较稳定,但在受潮或加热时容易发生分解,在酸性溶液中(pH<4)较稳定,在中性以上的溶液中(pH>7.6)非常不稳定。
在有氧存在下,维生素C(AH2)首先降解形成单价阴离子(AH-),并很快通过单电子氧化途径转变为脱氢抗坏血酸(A),温和的还原反应可将脱氢抗坏血酸转化回抗坏血酸(维生素C),但在碱性环境中,脱氢抗坏血酸的转化是不可逆的,其内酯环被水解打开形成2,3-二酮基古洛糖酸(DKG),2,3-二酮基古洛糖酸进一步降解引起维生素C活性的损失。维生素C降解最终阶段中的许多产物可以与氨基酸反应引起食品发生非酶褐变,且参与风味物质的形成。光、射线、Cu2+和Fe2+等金属离子均会加速维生素C氧化降解。植物组织中存在的氧化酶(如抗坏血酸氧化酶、多酚氧化酶、过氧化物酶、细胞色素氧化酶)也可以破坏维生素C。
作用
1、参与羟化反应
羟化反应是体内许多重要物质合成或分解的必要步骤,在羟化过程中,必须有维生素C参与。
(1)促进胶原合成,维生素C缺乏时,胶原合成障碍,从而导致坏血病。
(4)维生素C能提升混合功能氧化酶的活性,增强药物或毒物的解毒(羟化)过程。
2、还原作用
维生素C可以是氧化型,也可以是还原型存在于体内,所以可作为供氢体,又可作为受氢体,在体内氧化还原过程中发挥重要作用。
(1)高浓度的维生素C有助于食物蛋白质中的胱氨酸还原为半胱氨酸,进而合成抗体。
(2)维生素C能使难以吸收的三价铁还原为易于吸收的二价铁,从而促进铁的吸收。此外,还能使亚铁络合酶等的巯基处于活性状态,以便有效地发挥作用,故维生素C是治疗贫血的重要辅助药物。
(3)维生素C能促进叶酸还原为四氢叶酸后发挥作用,故对巨幼红细胞性贫血.也有一定疗效。
来源
维生素C主要存在于蔬菜和水果中,植物种子(粮谷、豆类)不含维生素C,动物性食物除肝、肾、血液外含量甚微。蔬菜中的青椒、番茄、菜花及各类深色叶菜类,水果中的柑橘、柠檬、青枣、山楂、猕猴桃等,维生素C含量均很丰富。
化学构造
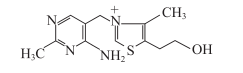
维生素B1又称硫胺素(thiamin),由一个含氨基的嘧啶环和一个含硫的噻唑环通过亚甲基桥连接而成。特性
维生素B1为白色至黄白色细小结晶,熔点249℃,具有潮解性,溶于水,微溶于乙醇,不溶于有机溶剂,气味似酵母,味苦。维生素B1分子中有两个碱基氮原子,一个在氨基基团中,另一个在具有强碱性质的季铵基团中,因此维生素B1能与酸反应形成相应的盐。同时由于季铵盐氮的存在,维生素B具有强碱性,在食品的整个正常pH范围内完全离子化,其电离程度取决于pH值。
维生素B1是B族维生素中最不稳定的一种,温度和pH值是影响其稳定性的重要因素。在低水分活度和室温条件下,维生素B1稳定性相当高。随食品加工和储藏温度的升高和水分活度的增加,维生素B的损失也逐渐增多。在酸性条件下维生素B是稳定的,pH值3.5以下加热至120℃仍不分解,而在中性或碱性条件下煮沸或是室温储藏维生素B1也会被破坏。
维生素B1的热降解通常由两环之间的亚甲基桥的断裂引起,其降解速率和机制受pH值和反应介质的影响较大。当pH值小于6时,维生素B的热降解速度缓慢,亚甲基桥断裂释放出较完整的嘧啶和噻唑组分;pH值在6~7之间,维生素B1的降解速度加快,同时噻唑环碎裂程度增加;在pH值为8时,降解产物中几乎没有完整的噻唑环,而是许多种含硫化合物。维生素B1热解过程中噻唑环开环分解形成硫、硫化氢呋喃、噻吩和二氢噻吩等物质,使烹调食品产生“肉香味”。食品组分中的单宁能与维生素B1形成加成物而使其失活,类黄酮使其分子反生变化,二氧化硫或亚硫酸盐使亚甲基碳上发生亲核反应而导致其降解,胆碱使其分子开裂而加速其降解,亚硫酸盐与嘧啶环上的氨基反应使得其发生损失。但蛋白质与维生素B1的硫醇形式形成二硫化物可阻止其热降解。
作用
维生素B1在体内的主要功能是以辅酶的形式参与能量和三大产能.营养素的代谢,此外,维生素B1在神经组织中具有一种特殊的非辅酶功能,并且与维持正常食欲、胃肠蠕动和消化液分泌以及心脏功能和生长发育都有一定的关系。
来源
维生素B1广泛存在于各类食物中,其良好来源是动物内脏(肝、肾、心)、瘦肉、全谷类、豆类和坚果类。谷物仍是我国传统饮食摄取维生素B的主要来源。但过度碾磨的精白米、精白面会造成维生素B1大量丢失。
化学构造
维生素B2,又称核黄素(riboflavin),是含有核糖醇侧链的异咯嗪衍生物,其母体结构为7,8-二甲基-10-(1'-核糖醇)异咯嗪。特性
维生素B2为黄至黄登色针状结晶,熔点282℃,微溶于水(27.5℃时100mL水可溶12mg),极易溶于碱液,水溶液呈现黄绿色荧光,不溶于有机溶剂,微臭,味微苦。
维生素B2在酸性环境中最稳定,在中性环境中稳定性降低,在碱性环境中迅速分解。维生素B2具有较强的热稳定性,不受空气中氧的影响,即使在120℃下加热6h也仅有少量被破坏,而此时维生素B2全部丧失。在食品热加工、脱水和烹调中维生素B2,损失较少,一.般能保存90%以上。但是维生素B2对光(特别是紫外线)非常敏感,光降解反应是引起其破坏的主要因素,如牛奶在日光下存放2h后维生素B2损失50%以上,放在透明玻璃器皿中也会产生“日光臭味”,导致营养价值降低。维生素B2的光降解反应分为两个阶段:第--阶段是在光辐照表面的迅速破坏阶段;第二阶段为一级反应,系慢速阶段。光强度是整个反应速度的决定因素。维生素B2在酸性或中性条件下光解为光色素(lumichrome),在碱性条件下光解生成光黄素(lumiflavin)。光黄素是一种强氧化剂,其氧化性强于维生素B2,可以破坏许多其他的维生素,尤其是维生素C。
作用
维生素B2参与体能生物氧化与热量代谢,在维生素B6和烟酸代谢中发挥作用。参与体内的抗氧化防御系统和药物代谢。维生素B2缺乏主要表现为口角炎、唇炎、舌炎、眼部症状、皮炎、阴囊炎等。长期缺乏可引起儿童生长发育迟缓、轻中度缺铁性贫血。一般情况下,维生素B2不会引起过量中毒,维生素B2大量存在于谷物、蔬菜、牛奶和鱼类等食物中,肝是最丰富的来源之一,肾、脑、心脏也含有相当可观的维生素B2。
来源
维生素B2是我国饮食中最容易缺乏的营养素之一。良好的食物来源主要是动物性食物,以及肝、肾、心、蛋黄、乳类尤为丰富,植物性食物中则以绿叶蔬菜类,如菠菜、韭菜、油菜及豆类中含量较多,而粮谷类含量较低,尤其研磨过于精细的粮谷类食物。
化学构造
维生素B6,又称吡哆素,是吡啶的衍生物,其基本结构是2-甲基-3-羟基-5-羟基甲基吡啶。维生素B包括吡哆醇(pyridoxine,PN)、吡哆醛(pyridoxal,PL)和吡哆胺(pyrodoxamine,PM)三种形式,它们的差别在于4位上一碳取代基的不同,分别为醇、醛和胺。特性
维生素B6的三种形式均为白色晶体,易溶于水和乙醇,微溶于有机溶剂,无臭。维生素B6在食品加工中可发生热降解和光化学降解,也可能与蛋白质发生不可逆结合,从而降低其生物活性。维生素B6的三种形式都具有热稳定性,其热降解与pH值有关,在酸性溶液中所有维生素B6都是稳定的,在碱性溶液中容易发生分解,其中吡哆胺损失最大。维生素B6对光敏感,尤其是紫外线,光降解的最终产物是无生物活性的4-吡哆酸。维生素B6可与蛋白质中的含硫氨基酸(如半胱氨酸)发生加成反应生成无生物活性的含硫衍生物,或与其他氨基酸作用生成Schiff碱,在酸性条件下这些Schiff碱会进一步解离或是发生重排生成环状化合物。此外,维生素B6也可与自由基反应而生成无活性产物,如维生素C降解产生的羟自由基可以直接进攻吡啶环的C6位,生成无生物活性的6-羟基衍生物。
作用
维生素B6在人体内主要以磷酸吡哆醛的形式参与氨基酸的合成与分解代谢,作为许多氨基酸代谢酶的辅酶,还能催化血红蛋白的合成,促进肌肉与肝中的糖原转化,参与亚油酸合成花生四烯酸,以及胆固醇的合成与转运等。此外,维生素B6能抑制呕吐、促进发育等。
来源
维生素B;广泛存在于各种食物中,植物性食物主要以吡哆醇、吡哆胺及其糖基化形式存在,而在动物性食物中则主要以吡哆醛及其磷酸化形式存在,其良好的来源为肉类,尤其是肝。豆类中的黄豆、鹰嘴豆和坚果中的葵花子、核桃等均有丰富含量。
化学构造
叶酸(folate),是一系列与蝶酰谷氨酸(pteroylgglutamic)化学结构相似、生物活性相同的化合物的总称,其分子由蝶啶(pteridinenucleus)、对氨基苯甲酸(p-amiNObenzoicacid)和谷氨酸(glutamicacid)三部分组成。天然存在的叶酸是含有3~7个谷氨酸残基的聚谷氨酰叶酸,其活性形式是蝶啶环中5、6、7、8位加上4个氢原子的四氢叶酸(THFA)。特性
叶酸为黄色或橙色薄片状或针状结晶,微溶于水,但其钠盐溶解度较大,不溶于有机溶剂,无臭,无味。叶酸在维生素中是较不稳定的一种,在水溶液中易被光解破坏,在酸性溶液中对热不稳定,超过100℃即被破坏,但在中性和碱性溶液中即使加热到100℃维持1h也不被破坏。各种叶酸的衍生物以蝶酰谷氨酸最稳定,四氢叶酸最不稳定,易遭受氧化降解而失去活性。硫醇、维生素C等还原剂能清除氧自由基,防止四氢叶酸的氧化作用,可以从多方面保护叶酸。环境中的亚硫酸盐与叶酸作用,导致叶酸侧链解离,生成还原型蝶啶-6-羧醛和氨基苯甲酰谷氮酸。
作用
四氢叶酸(THFA)是人体重要生化反应中一.碳单位的运载体,在嘌呤、胸腺嘧啶和肌酐-5磷酸的合成,甘氨酸与丝氨酸的相互转化,组氨酸向谷氨酸转化,同型半胱氨酸向蛋氨酸转化过程中充当一碳单位载体,因此不仅影响DNA和RNA合成,还可以通过蛋氨酸的代谢,影响磷脂、肌酸、神经介质以及血红蛋白的合成。因此,叶酸在快速的细胞分裂和生长过程中(如婴儿发育、胎儿期)有极重要的作用。叶酸能促进骨髓中的幼稚细胞发育成熟,形成正常形态的红细胞,从而避免巨幼红细胞贫血。
来源
叶酸广泛存在于动、植物性食物中,肝、肾、绿叶及黄叶蔬菜、酵母等含量丰富;肉类、蛋、豆类、麦胚、谷类及水果等食物含叶酸较多。
化学构造
泛酸(pantothenicacid),又称维生素B5、遍多酸,由β-丙氨酸与泛解酸(2,4-二羟基-3,3-二甲基酸)以酰胺键相连而成,是辅酶A的重要组成部分。特性
泛酸为黄色黏稠油状物,呈酸性,易溶于水和乙醇,不溶于有机溶剂,在空气中稳定,对氧化剂和还原剂极为稳定,但对酸、碱、热不稳定。泛酸在碱性溶液中水解为β-丙氨酸与泛解酸,在酸性溶液中水解为泛解酸的γ-内酯,在pH值为5~7的水溶液中最为稳定。在食品加工和储藏过程中,尤其在低水分活度条件下,泛酸具有相当好的稳定性。在烹调和热加工过程中,泛酸损失率随着处理温度的升高和溶水流失程度的增大而增大,通常在30%~80%之间。
来源
泛酸在食物中普遍存在,尤其以动物性食物、谷类整粒及豆类中含量丰富。食物中的生物素以游离或与蛋白质结合的形式存在。生物素的可利用性不同,玉米和大豆中的生物素可全部利用,小麦中的则难以利用。动物组织、蛋黄、番茄、酵母、花菜等是生物素的丰富来源。