-
雌激素受体 编辑
雌激素受体包括两大类:一是经典的核受体,包括ERα和ERβ,它们位于细胞核内,介导雌激素的基因型效应,即通过调节特异性靶基因的转录而发挥“基因型”调节效应;二是膜性受体,包括经典核受体的膜性成分以及属于G蛋白偶联受体家族的GPER1(GPR30)、Gaq-ER和ER-X ,它们介导快速的非基因型效应,通过第二信使系统发挥间接的转录调控功能,其中一些似乎只在脑局部起作用。这两类受体在机体内的分布具有组织/细胞特异性,参与了对诸如生殖、学习、记忆、认知等多种功能的调节。
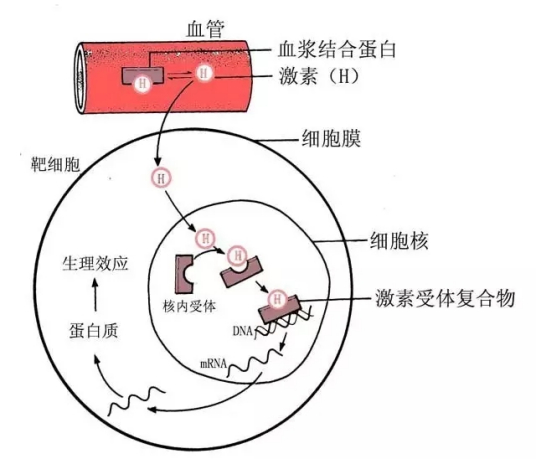
近年研究就发现经典雌激素受体也可位于细胞膜或细胞浆,雌激素与其结合后启动第二信使系统。雌激素在人体介导了很多生物学效应,而最初人们认为它的功能只受核受体的调控,即雌激素以自由扩散形式通过质膜,并与核受体紧密结合,通过结合靶基因上的雌激素应答元件(estrogen response element, ERE)调节基因表达或与其他核蛋白相互作用以改变基因的转录活性。近年的研究还发现了很多可介导快速非基因效应的膜性雌激素受体,如G蛋白偶联雌激素受体1(G protein-coupled estrogen receptor 1,GPER1)又叫G蛋白偶联受体30(G protein-coupled receptor 30,GPR30)、Gaq-ER 和ER-X,经典核受体也具有膜性成分。本文就雌激素两种受体的结构、信号转导途径及其组织分布作一综述。
雌激素核受体
即经典的雌激素受体,包括ERα、ERβ两种亚型,二者的结构相似,有A、B、C、D、E、F、J几个区域。A/ B区具有一个非配体依赖的的转录激活区(ligand independent aCTivation function 1,AF-1),该功能区不依赖配体即雌激素的激活,可能参与了调节雌激素与受体的结合以调节雌激素应答基因的转录。C区称为DNA结合域(DNA binding domain,DBD),两种受体此区域基本一样,含有相同的外显子。该区含有一个双锌指结构,两个锌指结构协同作用,共同调节此区域与特异DNA的结合,以达到转录靶基因的目的。D 区的作用是结合DNA,有时还会影响受体蛋白质的DNA结合位点的结构(另有维基百科指出D区的作用是作为C区和E区的铰合)。E/F 区称为配体结合域(ligand binding domain,LBD)。E区作用最多,例如与雌激素的结合、受体二聚化、核定位及与辅助激活因子或辅助抑制因子的结合等。同时E区还包含有另外一个依赖配体的转录激活区(ligand-dependent activation function 2,AF-2),AF-2遇到不同的雌激素会呈现出不同的构像,并决定转录靶基因所需要结合的辅助激活因子和辅助抑制因子。ERβ的AF-1功能微弱而AF-2与ERα的AF-2相似,提示它们在转录水平对不同的雌激素反应性基因作用不同,即转录基因需要AF-1和AF-2时ERβ的功能较ERα弱;在不需要AF-1 时两种ER的功能相当。AF-1与AF-2 的相互配合,能够使转录因子获得最大的转录活性。当DBD与DNA结合后,AF-1即可激活DNA的转录活性,AF-2与LBD相重叠,当AF-2区与雌激素结合后,即可激活DNA的转录。F区功能尚不明朗。D/E/F统称为配体结合区,两种亚型雌激素受体此区只有53%的相同氨基酸序列,因此两种受体既有共同的配体,也有各自不同的配体。
雌激素的膜性受体
核受体型 指经典的核受体也可见于细胞膜,故称核受体型膜受体。早在1977年,Pietras等发现雌激素可以通过细胞膜结合位点快速上调子宫内膜细胞cAMP水平,因而推测存在胞膜性ER(membrane estrogen receptor,mER)。1995年Pappas等首次证实质膜上存在ERα,可以与针对核受体不同结构域的各种抗体相互作用,提示两种受体结构极为相似。越来越多的证据认为经典的ERα可以定位于胞膜,作为膜性雌激素受体,表达于MCF-7人乳腺癌细胞膜,Song等运用激光共聚焦发现在雌二醇(E2)刺激下,经典的ERα转位至细胞膜。Razandi等在CHO细胞中发现ERα和ERβ除了在细胞内表达外,细胞膜上也有分布。与细胞内受体相比,膜性受体只占2%~3%。
核受体类似型 意即与核受体结构类似但不完全相同的膜性受体。用针对ERα不同结构域的多种抗体, 发现在子宫中存在5种分子量不同的蛋白质。因此,有理由认为存在膜性ER,它们虽然与核ER有关,但结构有差别。所有这些雌激素结合蛋白可能来自核受体不同的剪切方式。这就使它们可以插入跨膜区,保存核受体的配体结合结构域,丢弃DNA结合结构域和其他部分,从而产生多种膜受体,如ERα的变异体ER-46。
膜性受体GPER1 GPER1也叫GPR30,是真正意义上的膜性受体,为一类由375个氨基酸残基组成的7 次跨膜的G蛋白偶联受体(G protein-coupledreceptor,GPCR)。Bologa等发现了一种非固醇类化合物G-1,它与ERα和ERβ的亲和力非常低,而与GPR30亲和力却是雌激素的近两倍,因此被广泛用于研究GPR30的生物效应中,也因此被国际药理学联合会(IUPHAR IUP)命名为GPER1。关于GPER1亚细胞位点的学说仍存在争议。传统理论认为,GPCR配体结合位点均位于细胞外表面,但现已证实,当其配体为脂溶性时,GPCR亦可在细胞质内或核内结合配体产生功能。在不同组织来源的细胞中,GPER1与配体结合时均具有高亲和力、高异性、可置换性等膜受体的特性,同时,RT-PCR和免疫细胞化学检测所得的结果也提示其主要位于细胞膜上。雌激素可自由通过胞膜的特性使GPER1亦有位于细胞内的可能,Revankar等将绿色荧光蛋白(GFP)与GPER1结合,并使用各种亚细胞结构标记物作为定位对照,在共聚焦荧光显微镜下发现GPER1-GFP复合体主要沉积于细胞内质网上,Ga亚基与Gbg亚基结合,提供GPER1启动的必要信号,在适当的条件下,胞内GPER1可能向细胞表面易位。Sakmoto等用细胞内细胞器标记物和免疫电镜等特殊标记显示GPER1主要定位于神经元的高尔基复合体而非细胞表面。我们的工作发现GPER1主要位于海马锥体细胞胞浆内的膜性结构如粗面内质网,也见于细胞膜和线粒体。造成这种差异的原因可能是各实验室所用抗体的不同、或者细胞的状态不同等。
其他类型 新近发现的膜性受体还包括ER-X和Gaq-ER。ER-X不同于经典的核受体,也不是核受体的变异体,它与ERα有相同的C区域,但它不是ERα的剪切体,可能是一种新的基因。Paech等发现高表达的ER-X见于野生型与ERα基因敲除鼠、转基因AD模型鼠生后1~7天而非成年的新皮质、下丘脑、小脑,缺血性脑损伤或可以诱导其表达。它可能具有引导脑自分泌和旁分泌的功能,有保护神经元的作用。Qiu等用全细胞记录方法在敲除GPER1豚鼠的弓状核中发现了一种依赖Gaq蛋白的膜性受体,它不同于其他膜性受体而是一种调节GABAB受体去敏感化的ER,主要通过Gaq蛋白激活磷脂酶C介导向上的蛋白激酶、调控蛋白激酶A,并最终改变基因的转录活性。它也属于G蛋白偶联受体家族,于是将其命名为Gaq-ER。
雌激素细胞内信号转导包括:核启动的类固醇信号传送(nuclear-initiated steroid signaling,NISS)即基因组作用模式和膜启动的类固醇信号传送(membraneinitiated steroid signaling,MISS)即为非基因组作用模式。
NISS
雌激素介导的基因组作用模式分为三步:雌激素通过扩散进入细胞或通过细胞内原位合成,和核内ER结合,激活形成ER同源或异源二聚体,激活的ER与DNA增强子雌激素应答元件(estrogen responseelement,ERE)合,ER- ERE复合物促使形成转录起始复合物并诱导转录。除ERE机制外,ER 还能结合到其他转录因子,然后结合到靶基因启动区的活化蛋白1(activating protein 1,AP-1)位点,调节基因转录活性。
经典转录调控途径:与配体结合的ER发生构型改变,形成同二聚体或异二聚体,二聚体与共调分子相互作用,与靶基因的ERE结合,启基因转录和翻译。
非经典转录调控途径:ER通过结合AP-1、特异蛋白1(SP-1)等增强子元件间接调控基因转录。在此信号途径中,与配体结合的受体二聚体需要转录因子Fos Jun的共同作用而进行转录激活。
中间途径:即无典型的ERE,如孕激素受体(PR)启动子只有半个ERE,位于AP-1和SP-1位点附近。这些区域在乳腺癌细胞雌激素调节的PR表达中都起作用,可能是ER增强AP-1和SP-1在半ERE的募集,或共激分子需要这两种转录因子才能稳定地募集到启动子。
MISS
雌激素能在数秒钟内改变神经元的电生理特性,在几分钟之内降低不表达核受体的神经元的Ca2+电流,导致特异性增强基因表达的蛋白质如MAPK途径、PKA、CREB等的活化。雌激素可以通过膜ER快速激活细胞内的第二信号系统,间接调节一系列基因转录,在多种细胞类型中快速发挥生物学效应。这些效应包括:(1)迅速激活ERK/MAPK信号通路;(2)通过Gds活化腺苷酸环化酶(cAMP),促进cAMP调节基因转录的活性;(3)通过Gaq活化磷脂酶C(PLC),激活PKC并增加内源性Ca2+;(4)通过Gai合成一氧化氮(NO);(5)增强Src-Ras-PI3K通路活性、胞吐作用、泌乳素的分泌及钙通路活性;(6)使Src、Src同源性胶原蛋白、内皮黏附分子、环前列腺素和一些未知磷脂酶的表达水平增加。
ER介导的信号转导途径
MAPK/ERK信号转导途径——ER活化MAPK/ERK的过程主要靠相关分子形成复合体来介导,主要有ERα-Shc-IGFR复合体和PELPl/MNAR-ER-Src复合体。前者主要是在Shc 的PTB/SH2 结构和ERa 的AF-1的参与下,通过磷酸化的Shc、IGFR与ERα结合,从而发挥生物效应。而后者中,PELP1/MNAR既定位于细胞核又定位于细胞膜,MNAR 和PELP1上有两种不同的模体,可以分别ERa、c-Src结合形成复体,从而发挥作用。
PI3K/Akt信号转导途径——PI3K与多种细胞因子转导途径相关,已有报道PI3K可以与EGFR和IGFIR相互作用,即可能有ERct-PI3K-生长因子受体复合体的存在,IGF-1R是乳腺癌细胞增殖的关键受体,主要通过PI3K/Akt途径抑制细胞的凋亡。PI3K 可以介导多种细胞效应,而Akt则是PI3K的下游分子,Akt的活化能是因为ERα与PI3K相互作用。雌激素可以通过Ras/PI3K/Akt通路诱导凋亡相关蛋白BAD的磷酸化,提PK3K/Akt 信号通路在雌激素抵抗肿瘤坏死因子、超氧化物等因素诱导凋亡的过程中具有潜在的重要意义。
JNK信号转导途径—— 在表达ER的CHO细胞中,E2通过ERβ激活JNK,而通过ERα抑制这种激酶。JNK可以诱导细胞的凋亡作用,但有些激活JNK亡信号被存活信号通路所阻断,包括NF-kB、Akt/PKB和ERK。
GPER1介导的信号转导途径
MAPK/ERK信号转导途径—— 雌激素结合GPER1通过下游分子Src、Ras、Raf、Mek级联快速激活ERK,促进细胞增生并延长其生长周期。MAPK激活后在胞质中激活一系列其他蛋白激酶或进入核内引起转录因子AP-l、NF-kB磷酸化而调控基因的表达。用MCF-7乳腺癌细胞实验首次证实雌激素可以通过激活ERK信号级联反应刺激乳腺细胞的增生。GPER1介导的MAPK途径和下文介绍的PI3K途径都是通过反式激活EGFR来完成的。
PI3K/Akt途径——ER介导的PI3K-Akt-NO转导途径中,ER主要靠和其他配体结合成聚合体来起作用,如在血管内皮细胞中,膜ERα与Gai的偶联才促进雌激素刺激eNOS的活化。在单层扁平上皮细胞、成纤维细胞、平滑肌细胞以及脂肪细胞中大量存在的小窝结构中,也是形成了一个ERα/纹蛋白/小窝蛋白/eNOS复合体来发挥作用的。GPER1介导的转导途径主要靠PI3K-Akt-NO途径来完成,雌激素与GPER1结合后,激活磷脂酰肌醇-3(PI3)激酶,进而激活蛋白激酶B(Akt)激酶,调节eNOS活性,产生NO。Vivacqua等发现活化的EGFR同时还能动员胞内钙离子和激活磷脂酰肌醇-3激酶-Akt(PI3K/Akt)途径,同样达到促细胞增殖的效果。
cAMP/PKA途径—— 雌激素可以通过GPER1活化腺苷酸环化酶(AC),并通过其作用使胞内环磷酸腺苷(cAMP)增加,激活cAMP依赖的蛋白激酶A(PKA),使Raf-1失活而减少ERK的量, 进而调控细胞生长。如雌激素可刺激cAMP-PKA途径活化,激活cAMP反应元件介导的转录活性,而使细胞周期蛋白D1(Cyclin D1)的表达增高加速器分裂增殖。
Ca2+途径——Revankar等用离体研究发现在调节Ca2+途径来实现生物效应;Dennis等发现在转染了GPER1的SKBr3细胞也存在这种现象。Romanò等在体研究发现GPER1参与了雌激素对下丘脑促性腺激素释放激素细胞内Ca2+的调节并涉及到GABAA受体。
ER-X和Gaq-ER介导的信号转导途径
ER-X介导的雌激素受到脑发育以及缺血性脑损伤的调节并涉及到MAPK-ERK1/2信号途径,ERK1和ERK2 的激活对神经元的存活和生长非常重要。Qiu等在敲除ER鼠下丘脑的弓状核用一种作用与雌激素相仿的非甾体类混合物STX来靶向标记PLC-PKC-PKA,由此发现Gaq-ER参与了对PLC-PKC-PKA途径的调节,具体程可能是:雌激素通过结合受体来激活Gaq,激活的Gaq再激活PLC,从而使PIP2水解出DAG激活PKC,PKC活化cAMP,升高的cAMP再激活PKA,从而使胞膜的钾离子通道打开诱发相应的生物学效应。
雌激素受体的组织分布和表达量随性别及年龄的不同有所区别在不同的组织中各种受体的含量及生物功能也有不同。
雌激素受体与骨组织
骨组织中,核受体ERβ的含量比ERα含量高,它们的含量随着年龄的增长而减少,ERα作用可调节成骨细胞的生长,而ERβ参与了骨的形成与重吸收。GPER1也存在于骨细胞的成骨细胞和破骨细胞,在青春期时,它的表达处于低水平,但它的表达却不随着年龄的增长而发生特定的改变,它在骨组织中扮演的具体角色尚不清。
雌激素受体与生殖系统
子宫中雌激素受体以ERβ为主,可刺激子宫生长。GPER1在子宫内膜癌肿的表达高于正常子宫内膜。ERα主要在卵囊泡膜细胞和某些基质细胞中表达,ERβ存在于生长卵泡的颗粒细胞中,也可在一些基质细胞中表达。有研究发现GPER1在卵巢中的表达始于原始卵泡,但它在卵巢癌中却很低。在乳腺的上皮细胞(乳腺导管及小叶)和基质细胞中均发现了ERβ、ERα的表达而在小叶上皮中无表达。ERα对乳腺发育和泌乳至关重要,ERβ则关系不大,其表达随年龄增加而增强。人类乳腺癌细胞膜上存在GPER1,可以促进MAPK和Akt激酶信号通路的快速活化,GPER1 影响乳腺肿瘤的大小和转移性,而且GPER1与肿瘤大小呈现正向的关系。
雌激素受体与神经系统
ER在大脑各区域的分布不同,与学习记忆有关的脑区如大脑皮层、海马和基底前脑等部位以ERβ为主,而与生殖有关的脑区以ERα为主,两者只共存于少数细胞。Gaq-ER和ER-X主要发现于神经系统中,在最近的研究中发现,在缺血性脑卒中、转基因小鼠和阿尔茨海默病小鼠中,雌激素可通过MARK/ERK和PI3K/Akt细胞信号传导通路来快速、持续激活膜受体,起到保护神经元的作用。它主要影响空间记忆和突触可塑性。