-
腺苷酸环化酶 编辑
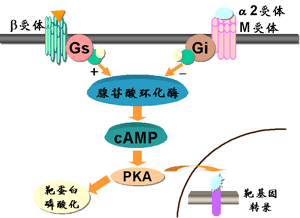
激素和相应的膜受体结合后,经G蛋白的中介激活腺苷酸环化酶。激素受体嵌在细胞膜的脂双层内,它与激素结合的部位面向细胞外侧。腺苷酸环化酶也居质膜中,位于细胞内侧。
G蛋白位于细胞质膜胞浆面的一种外周蛋白,由3个亚基Gα、Gβ及Gγ,由于α亚基结构和作用不同,可分为激动型G蛋白和抑制型G蛋白两类。
激动型 G蛋白(Gs)未被激活前,Gα蛋白与GDP结合,呈无活性状态,一旦受体与激素结合后,即可诱发G蛋白上的Gα-GDP 与GTP交换,成为活性状态的Gα-GTP 。同时,Gα-GTP即与Gβγ部分分离,并移动到邻近的βγ腺苷酸环化酶部位,以激活腺苷酸环化酶,后者催化ATP变成cAMP。但Gα-GTP的寿命是短暂的,因为Gα本身具有GTP酶的活性,可以水解GTP为GDP与Pi。又成无活性的Gα-GDP,并返回与Gβγ结合成完整的无活性的G蛋白(a-βγ)-GDP。
第一类腺苷酸环化酶(AC-I)
第一类腺苷酸环化酶存在于大肠杆菌E. coli等许多细菌中(如CyaA P00936)。这是第一类被描述的腺苷酸环化酶。据观察,缺乏葡萄糖的大肠杆菌产生cAMP作为一种内部信号,激活吸收和代谢其他糖的基因表达。cAMP通过结合转录因子CRP(也称为CAP)发挥该作用。AC-I是一种大分子细胞质酶(约100kDA),具有大的调节结构域(约50kDa)用于间接检测葡萄糖水平。截至2012年,AC-I没有得到晶体结构,但已经获得了一些间接的结构信息。已知其靠近N端的一半是催化部分,需要两个Mg2+离子。S103、S113、D114、D116和W118是五个不可或缺的残基。AC-I催化结构域与DNA聚合酶β的掌形结构域属于同一超家族。
第二类腺苷酸环化酶(AC-II)
这类腺苷酸环化酶是致病细菌(如炭疽芽孢杆菌Bacillus anthracis、百日咳杆菌BordetellapERTussis、铜绿假单胞菌Pseudomonas aerugiNOsa和创伤弧菌Vibrio vulnificus)在感染过程中分泌的毒素,例如炭疽毒素。这些细菌还分泌蛋白质使AC-II进入宿主细胞,随后外源腺苷酸环化酶破坏正常的细胞生理过程。AC-II的基因被称为cyaA。AC-II酶已知几种晶体结构。
第三类腺苷酸环化酶(AC-III)
由于第三类腺苷酸环化酶对人类健康的重要作用,它们被基于广泛的研究并因此成为了我们最熟悉的一类腺苷酸环化酶。它们也存在于一些细菌中,特别是结核分枝杆菌Mycobacterium tuberculosis,它们似乎在结核杆菌的发病机制中起着关键作用。大多数AC-III是整合膜蛋白,参与将细胞外信号转换为细胞内反应的过程。厄尔·萨瑟兰(Earl Sutherland)发现了AC-III在人体肝脏中的关键作用——肾上腺素间接刺激腺苷酸环化酶在“战或逃”反应(“fight orflight” response)中调动储存的能量,并因此获得了1971年的诺贝尔奖。肾上腺素的作用是通过G蛋白信号级联,将化学信号从细胞外穿过膜传递到细胞内(细胞质)。外部信号(在本例中为肾上腺素)与受体结合,受体将信号传递到G蛋白,G蛋白将信号传递给腺苷酸环化酶,腺苷酸环酶通过将三磷酸腺苷转化为AMP来传递信号。
cAMP是真核生物信号转导中的一个重要分子,即所谓的第二信使。腺苷酸环化酶通常被G蛋白激活或抑制,G蛋白与膜受体偶联,因此可以对激素或其他刺激做出反应。腺苷酸环化酶激活后,产生的cAMP作为第二信使,与蛋白激酶a和环核苷酸门控离子通道等其他蛋白相互作用并调节它们。
光激活的腺苷酸环化酶(PAC)是在纤细裸藻Euglena gracilis 中发现的,可以通过基因操纵在其他生物中表达。对含有PAC的细胞发射蓝光会激活它,从而迅速提高ATP向cAMP的转化率。这是神经科学研究的重要技术,因为它可以让他们快速提高特定神经元的细胞内cAMP水平,并研究神经活动增加对生物体行为的影响。通过修饰视紫红质鸟苷酰环化酶的核苷酸结合位点,研究人员最近设计出了一种绿光激活的视紫红质腺苷酸环化酶(CaRhAC)。
结构
大多数AC-III是具有12个跨膜片段的跨膜蛋白。它先由6个跨膜段组成,然后是C1细胞质结构域,接着是另外6个膜段,最后是第二个细胞质结构域C2。其发挥功能的重要部分是N端以及C1和C2区域。C1a和C2a亚结构域是同源的,并形成分子内“二聚体”作为活性位点。在结核分枝杆菌和许多其他细菌中,AC-III多肽只有一半长,包括一个六次跨膜结构域,然后是细胞质结构域,但其中两个形成功能性同二聚体,类似于具有两个活性位点的哺乳动物AC-III结构。在非动物AC-III中,具有催化活性的胞质结构域与其他(不一定是跨膜)结构域相连。
第三类腺苷酸环化酶结构域可进一步分为四个亚家族,称为IIIa至IIId类。动物的膜结合ACs属于IIIa类。
机制
反应发生需要两个金属辅因子(Mg或Mn)与C1上的两个天冬氨酸残基配位。它们对ATP的α-磷酸基上的核糖的3'-OH基团进行亲核攻击。C2上的两个赖氨酸和天冬氨酸残基选择ATP而不是GTP作为底物,因此该酶不是鸟苷酸环化酶。C2上的一对精氨酸和天冬酰胺残基负责稳定过渡状态。然而,在许多蛋白质中,这些残基发生突变而同时腺苷酸环化酶仍保持活性。
亚型
哺乳动物中有十种已知的腺苷酸环化酶亚型:ADCY1-ADCY10。(有时也有罗马数字表示,主要不要与表示腺苷酸环化酶类型(如AC-III)的罗马数字混淆。)其主要差异是于被调控方式,且在哺乳动物发育过程中在不同组织有差异地表达。
调控
腺苷酸环化酶由G蛋白调节,G蛋白可以以单体形式或异三聚体形式存在,由三个亚基组成。腺嘌呤基环化酶活性由异三聚体G蛋白控制。当复合物由α、β和γ亚基组成且GDP与α亚基结合时,G蛋白表现为非活性或抑制性形式。为了激活G蛋白,配体必须与受体结合并引起构象变化。这种构象变化导致α亚基与复合物分离并与GTP结合。这种G-α-GTP复合物随后与腺苷酸环化酶结合,并引起cAMP的激活和释放。而关闭信号,即腺苷环化酶去激活和抑制cAMP的机制,GTP水解导致的活性Gα-GTP复合物的失活而快速完成的,该反应由位于α亚基的GTPase的固有酶活性催化。它也受毛喉素以及其他亚型特异性效应物的调节:
·Ca2+以钙调素非依赖的方式抑制V和VI型同工酶。
·同工酶II、IV和IX受G蛋白的α亚基刺激。
同种型I、V和VI最明显地受到Gi的抑制,而其他同种型则较少受到抑制性G蛋白的双重调节。
·可溶性AC(sAC)不是跨膜形式,不受G蛋白或毛喉素的调节,而是作为碳酸氢盐/pH传感器。它锚定在细胞内的不同位置,并与磷酸二酯酶一起形成局部cAMP信号域。
在神经元中,钙敏感的腺苷酸环化酶位于钙离子通道旁,以加快对Ca2+内流的反应;它们可能在学习过程中起着重要作用,其证据之一是腺苷环化酶是重合检测器(coincidence deteCTors),这意味着它们仅由一起发生的几个不同信号激活。在外周细胞和组织中,腺苷酸环化酶似乎以亚型特异性的方式与特定受体和其他信号蛋白形成分子复合物。
第四类腺苷酸环化酶(AC-IV)
AC-IV首次在嗜水气单胞菌Aeromonas hydrophila中发现,鼠疫耶尔森菌Yersiniapestis的AC-IV也同样已经被报道。它们是最小的腺苷酸环化酶类;来自耶尔森氏菌的AC-IV(CyaB)是由19 kDa亚基组成的二聚体,没有已知的调节成分。AC-IV与称为CYTH(CyaB,硫胺素三磷酸酶)的马马利亚硫胺素三磷酸酶形成一个超家族。
第五、六类腺苷酸环化酶(AC-V IV)
这两类形式的腺苷酸环化酶只在特定的细菌(例如瘤胃普雷沃氏菌Prevotella ruminicola和菜豆根瘤菌Rhizobium etli)中被报道,并且尚未被广泛描述。VI类酶具有与III类酶相似的催化中心。
腺苷酸环化酶的电镜酶细胞化学试验方法
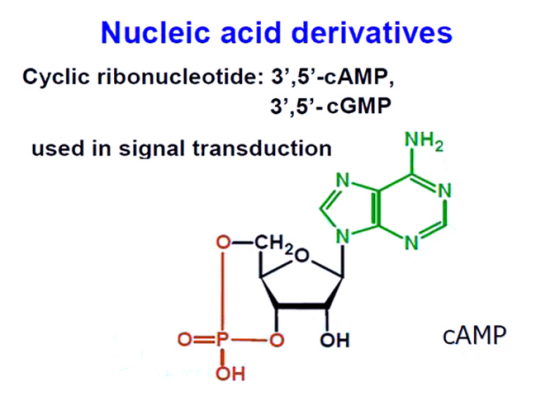
腺苷酸环化酶主要分布于细胞质膜、核膜和内质网膜上。它也是一种磷酸酶,能催化ATP形成3',5'-环磷酸腺苷(cAMP)并释放出焦磷酸。
Howell等人(1972)首先用亚胺二磷酸腺苷(AMP-PNP)作底物,成功地对动物细胞中的腺苷酸环化酶进行了定位。现已确认,在未固定和固定的组织中,ATP-PNP是腺苷酸环化酶的专一性底物,在腺苷酸环化酶的作用下,能生成cAMP和PNP,后者与捕捉铅离子反应,生成一种不溶性的电子密度很高的产物。但铅能在一定程度上抑制酶活性,为克服这一缺点, Fujiomto等(1981)设计了使用二钾亚砜(DMSO)的硝酸铅法。下面介绍的是Fujimoto等人使用的DMSO的硝酸铅法。
固定:配制固定液的缓冲液使用0.1M pH为7.4的二甲胂酸钠缓冲液,内含8%蔗糖、5%的DMSO。
固定液配方: 2%多聚甲醛和0.25%戊二醛混合液。对于肝脏来说,1%以上的戊二醛固定时,可导致明显的酶失活。但若加5%的DMSO,酶活性能较好保存。总体来说,多聚甲醛与戊二醛的浓度应因组织而异。一般在0~4℃固定2小时或室温固定1小时。
洗涤:用配制固定液相同的缓冲液漂洗1小时~过夜,期间更换缓冲液数次;而后进行厚切片;
孵育:配方及条件见\ref{table:Enzyme-7},
作为腺苷酸环化酶特异底物的AMP-PNP在室温中或长期冷冻保存时,ATP、AMP-PN 和AMP-PNP-P等化合物容易增多,应引起注意。左旋咪唑的加入是由于底物AMP-PNP 容易受到组织的碱性磷酸酶分解,加入左旋咪唑能抑制该酶的活性,在碱性磷酸酶活性高的组织内,左旋咪唑的浓度等因素需特别注意考虑。氟化钠为腺苷酸环化酶的激活剂,应根据组织不同进行前处理后,将氟化钠加入到孵育液中。
后固定:后固定前,必须用不含DMSO的二甲胂酸钠缓冲液进行充分洗涤。
残存的DMSO可以与锇酸反应,产生扩散性的微细颗粒。后固定用二甲胂酸钠缓冲液配制的1%~2%的锇酸。锇酸后固定时对酶反应产物有一定的影响,有人认为固定时间不应超过10min,超过后可引起酶反应产物颗粒变粗变大、扩散,有时由于全部溶出而导致完全没有反应产物的阴性结果。因此认为用锇酸固定时间最好控制在5分钟内。也有用2~4%的戊二醛代替锇酸进行后固定。
对照实验中可除去底物AMP-PNP,也可在对照实验的孵育液中加入5mM的四氧嘧啶。
DMSO的硝酸铅法孵育液配方及条件table:Enzyme-7
孵育液配方:& Tris-顺丁烯二酸缓冲液(pH 7.4) 80mM
蔗糖 8%
氟化 20mM
茶碱 2.0mM
AMP-PNP 0.5mM
硫酸镁 4.0mM
左旋咪唑 2.5mM
DMSO 5%(V/V)
硝酸铅 2.0mM
孵育条件: 孵育液pH 7.4
孵育温度 37℃