-
硫化物 编辑
中文名:硫化物
外文名:sulfide
所属学科:化学
主要组成:酸式盐、正盐和多硫化物三类
-2价硫的化合物,金属硫化物可以看成氢硫酸的盐。金属与硫直接反应或者将硫化氢气体通入金属盐溶液,或者往盐溶液中加入硫化钠,都可制得金属硫化物。
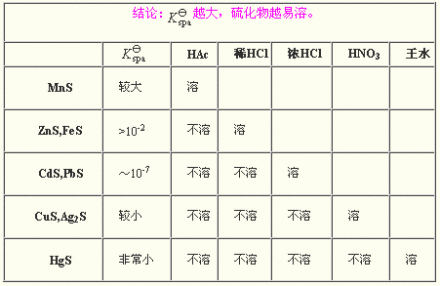
碱金属硫化物和硫化铵易溶于水,由于水解其溶液显碱性。碱土金属、钪、钇和镧系元素的硫化物较为难溶。当阳离子的外层电子构型为18电子和18+2电子时,往往由于较强的极化作用而形成难溶的、有颜色的硫化物。大多数不溶于水的硫化物可溶于酸并释放出硫化氢,极难溶的少数金属硫化物(如CuS、HgS)可用氧化性酸将其溶解,此时S被氧化成硫而从溶液中析出。难溶金属硫化物在溶液中存在溶解-沉淀平衡。控制溶液的酸度,可以改变溶液中S2- 离子的浓度,从而将溶解度各不相同的难溶金属硫化物分别沉淀出来。这是定性分析中用硫化氢分离、鉴定金属离子的基础。
无机硫化物通常可通过以下方法合成:(注:K为国际温度单位开尔文)
1、单质直接化合,例如:
C + 2S
2、硫酸盐或高价硫化物的还原,例如:
Na2SO4 + 4C→ Na2S + 4CO 1373K
In2S3 + 2
3、溶液中或高温的复分解反应,例如:
3SiO2 + 2Al2S3→ 3SiS2 + 2Al2O3 1373K
4、以硫代酸盐为原料制取,例如:
(NH4)2MoO4+ 4(NH4)2S + 4H2O → (NH4)2 + 8NH3·H2O
(NH4)2MoO4+ 2HCl --(加热)→ MoS3 + H2S + 2NH4Cl
5、高价硫化物加热分解,例如:
MoS3 --(加热)→ MoS2 + S
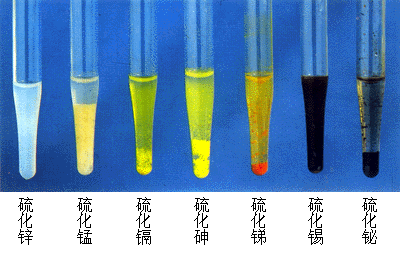
颜色
几种硫化物的颜色 | |||||||
Al2S3 | 黄 | GeS | 灰黑 | P4S5 | 亮黄 | CdS | 黄 |
Ga2S3 | 黄 | SnS2 | 黄 | P4S10 | 黄 | HgS | 红/黑 |
In2S3 | 黄/红 | SnS | 棕黑 | As4S4 | 红 | MnS | 绿/肉 |
InS | 酒红 | PbS | 黑 | As4S6 | 黄 | MoS3 | 红棕 |
Tl2S3 | 蓝黑 | As4S10 | 淡黄 | RuS2 | 灰蓝 | ||
Tl2S | 黑 | Sb2S3 | 橙红 | FeS2 | 黄 | ||
Bi2S3 | 棕黑 | ||||||
硫化物大多含有鲜艳的颜色,见上表。 除此之外,MoS2、Re2S7、FeS、CoS2、NiS、PtS2、Cu2S、CuS和Ag2S等过渡金属硫化物都是黑色的。
溶解性
金属的酸式硫化物都可溶于水,但正盐中只有碱金属硫化物和硫化铵可溶。一般地讲,金属硫化物的溶解度可通过阳离子极化力(离子电荷数/离子半径,Z/r)的大小来预测。阳离子极化能力的增强,将导致化合物共价性的增加,极性减小,因而溶解度也降低。水解
金属硫化物在水中都会发生不同程度的水解:
S2-+ H2O ⇌ HS-+ OH-
HS-+ H2O ⇌ H2S + OH-
H2S的pKa分别约为:pKa1 = 6.89 和 pKa2 = 15±2, 因此金属硫化物溶液会呈不同程度的碱性,而碱金属的硫化物溶液的碱性更是可以与相应的氢氧化物匹敌。
灼烧
灼烧硫化物矿物时可能发生两种反应:
硫化物转化为相应的氧化物,硫则转化为二氧化硫。例如由方铅矿制取铅时有一步为: 2PbS + 3O2 → 2PbO + 2SO2硫化物被氧化为相应的可溶硫酸盐。
以上两步都是冶炼金属时,转化硫化物矿石的重要方法。
氧化
硫化物中-2价的硫具有还原性,视条件不同可被氧化为硫、亚硫酸盐和硫酸盐等。
S2-- 2e-= S; -0.407V
硫化物酸碱性
硫化物和相应的氧化物类似,其酸碱性随周期和族的变化也和氧化物的类似,但硫化物的碱性不如氧化物强。
H2S | NaHS | Na2S | As2S3 | As2S5 | Na2S2 |
H2O | NaOH | Na2O | As2O3 | As2O5 | Na2O2 |
\ | 碱性 | 碱性 | 两性 | 碱性 |
同周期元素最高氧化态硫化物从左到右酸性增强;同族元素相同氧化态的硫化物从上到下酸性减弱;同种元素的硫化物中,高氧化态的硫化物酸性更强。因此As2S5酸性强于Sb2S5,而Sb2S5的酸性则要强于SnS2和Sb2S3。
硫化氢是一种无色有毒的气体,臭鸡蛋气味,空气中硫化氢的容许含量不超过0.01mg/L。硫化氢能够与人体的血红素中的亚铁离子结合生成硫化亚铁,使其失去反应活性。经常与硫化氢接触会引起嗅觉迟钝,消瘦,头痛等慢性中毒。实验室里常用金属硫化物与酸作用制备硫化氢。硫化氢的水溶液是氢硫酸,二元弱酸。无论在酸性介质还是碱性介质中,硫化氢的还原性都很强。
多硫化物是含有多硫离子Sn的化合物,n=2,3,4,5,6,...,9。多硫化物可由硫在硫化物溶液中煮沸制得,其溶液一般都为黄色,且颜色随n值的增加而加深。
多硫离子存在过硫键,类似于过氧化物,具有氧化性,但不及过氧离子氧化性强,反应发生歧化:
多硫化物在酸性溶液里很不稳定,酸化时即放出硫化氢和硫:
点滴法是鉴定硫离子和硫氢根离子的灵敏方法,其步骤为:在点滴板上混合可溶硫化物的碱性溶液和1%的硝普酸钠Na2(亚硝基铁氰化钠)溶液,若试样中存在S离子则会出现不同深度的红紫色,灵敏度1:50000。其机理是4-离子的生成。 除此之外,向点滴板中加入试液、浓盐酸、几颗对氨基二甲基苯胺晶体和0.1mol/L氯化铁溶液,若在2~3分钟后出现蓝色,也可证明硫离子的存在。机理是生成了蓝色的亚甲基蓝。
本大类矿物只占地壳总质量的0.15﹪,其中绝大部分为铁的硫化物,其他元素的硫化物及其类似类似化合物只相当于地壳总质量的0.001﹪。尽管其分布量有限,但却可以富集成具有工业意义的矿床,主要有有色金属,如Cu、Pb、Zn、Hg、Sb、Bi、Mo、Ni、Co等均以本大类矿物为主要来源,故本大类矿物在国民经济中具有重大意义。
依据成分中硫离子价态的不同和络阴离子的存在与否,硫化物矿物相应分为三类: 单硫化物:硫以S2-形式与阳离子结合而成,绝大多数为黑色; 过硫化物,硫以哑铃状对阴离子2-形式与阳离子结合而成;
硫盐矿物,硫与半金属元素砷、锑或铋组成锥状络阴离子3- 、3- ,以及由这些锥状络阴离子相互联接组成复杂形式的络阴离子与阳离子结合而成。
硫化氢系统是传统且较广泛的分析阳离子的方法,主要依据各离子硫化物溶解度的显著差异,将常见的阳离子分成五组。
组试剂 | HCl | 0.3 mol/L HCl, H2S 或 0.2~0.6 mol/L HCl TAA,加热 | NH3 + NH4Cl (NH4)2S 或 TAA,加热 | / | |
组的名称 | I组 银组 盐酸组 | II组 铜 锡组 硫化氢组 | III组 铁组 硫化铵组 | IV组 钙钠组 可溶组 | |
组内离子 | Ag Hg2 Pb | II A Pb Bi Cu Cd | II B Hg As(III,V) Sb(III,V) Sn(II,IV) | Al Mn Cr Zn Fe Co Fe Ni | Ba K Ca Na Mg NH4 |
由于H2S气体毒性大,且储存不便,故一般多以硫代乙酰胺(CH3CSNH2,TAA)水溶液作沉淀剂。
在酸性溶液中TAA水解产生H2S,可替代H2S: CH3CSNH2 + H + 2H2O ⇌ CH3COOH + NH4 + H2S↑ 在氨性溶液中水解生成HS,可替代(NH4)2S: CH3CSNH2 + 2NH3 ⇌ CH3-C(-NH2)=NH + NH4 + HS在碱性溶液中水解生成S,可替代Na2S: CH3CSNH2 + 3OH ⇌ CH3COO + NH3 + H2O + S 硫化物的其他应用还有:
二硫化钼是有机合成中的催化剂。由于含硫有机化合物(如噻吩)会使普通氢化催化剂中毒,因此二硫化钼可用于催化含硫有机物质的加氢反应。 硫化镉可用于制作光电池。 硫化铅被用于制作红外感应器。 多硫化钙、多硫化钡和多硫化铵是杀菌剂和杀虫剂。 二硫化碳在工业上被用作溶剂。此外,二硫化碳也被用来制取四氯化碳,有机化学中则用二硫化碳来插入-C(=S)-S-基团。 硫化锌和硫化镉被用来制造荧光粉,高纯度的硫化镉是良好的半导体。 三硫化四磷用于制火柴和烟火。 十硫化四磷用于制杀虫剂、润滑油添加剂和浮选剂。 硫化钠被大量用于硫化染料的制造、有机药物和纸浆的生产等。 硫化钙和硫化钡被用来制造发光漆。