-
类天疱疮 编辑
疾病简介
大疱性类天疱疮(Bullous pemphigoid,BP)是最常见的皮肤自身免疫性表皮下大疱病。好发于老年人,以泛发的瘙痒性大疱疹为特点,粘膜受累比较少见,可伴显著的病态。然而,BP的表现极为多样,开始容易被误诊,尤其在疾病的早期或不典型病例,患者可以完全没有大疱。对这些病例,诊断BP的前提首先需要高度怀疑,并立即采取适当的治疗措施。BP是器官特异性自身免疫病的范例。病人自身抗体的靶抗原是皮肤和粘膜中连接粘附复合物-半桥粒的两种成分 。
疾病历史
几个世纪以来,大疱性皮肤病的描述使用过许多术语。从18世纪开始,“天疱疮”这个词用于描述任何类型的大疱性皮疹。直到1953年,Lever基于其特殊的临床和病理学特点,认为BP是一个不同于天疱疮的疾病 。
十年后,Jordon,BERTner和同事们证明了BP患者有针对皮肤基底膜带
BP的皮肤表现极具多形性(图2-5).前驱期,即疾病的非大疱期,症状和体征常无特异性,可仅表现为轻微或严重、顽固的瘙痒,或伴表皮剥脱、湿疹样、丘疹和/或荨麻疹样的皮损,可持续数周或数月。这些非特异的皮肤表现可作为本病的唯一症状。大疱期
BP大疱期的特征表现为:在正常或红斑皮肤上的水疱和大疱,伴有荨麻疹样和浸润性的丘疹和斑块,皮损偶可呈环形或图形(见图2和3)大疱紧张,直径约1-4cm,疱液澄清,可持续数日。破溃后成为糜烂和结痂。有时,疱液可呈血色。皮损常对称分布,好发于肢体屈侧和躯干下部,包括腹部。在间擦部位可见增殖性的斑块。皮损消退后遗留色素改变,包括色素沉着或色素减退, 偶见粟丘疹。10%-30%病人口腔粘膜受累。眼、鼻、咽、食管和肛门生殖器区域的粘膜更少受累。约50%患者外周血嗜酸性粒细胞增多。
临床变异型
BP的许多临床变异型已为各种各样的术语所描述(见图4和图5)。偶而, 皮损可以是局限性的,如在胫前区(胫前类天疱疮)、孔口周围、在照射辐射区内、或限于瘫痪的肢体。仅掌跖受累,与出汗不良型湿疹相似(出汗不良型类天疱疮)。 皮损为成簇小的张力性大疱,与疱疹样皮炎相似(小疱型类天疱疮)。皮损可类似结节性痒疹(结节型类天疱疮)或表现为红皮病(红皮病型类天疱疮),还有,类天疱疮扁平苔藓(lichen planus pemphigoides)。
妊娠类天疱疮(曾称妊娠疱疹)是BP的一个特殊类型,发生在妊娠期(见妊娠类天疱疮)。常在孕中期或晚期发生,罕见在产后发生。早期为瘙痒的丘疹或荨麻疹样损害,继而发生水疱和大疱。皮疹首发于脐周和腹部,可泛发。
最后,儿童BP的临床特点(儿童期BP)与成人相似(见图5)。据报道可显著地累及手掌、足跖和粘膜。此外,还有一种特殊的类型,累及外阴和肛周(儿童外阴类天疱疮)。
伴发的疾病
大多数情况下,BP患者伴发内脏恶性肿瘤可能与患者的高龄有关。尽管在三个病例对照研究中,某些癌症(如消化道、膀胱和肺)和淋巴细胞增生性疾病的发生率高些,但BP患者恶性肿瘤高风险的趋势似乎是被边缘化了 。偶有个别病例,疱病显然与恶性肿瘤同时发生。因此,若有系统表现和非典型表现如BP发生在中年人,则建议作癌症的筛查。对普通人群中的BP病人,应推荐作与年龄相关的癌症筛查试验。
有罕见的病例报道,BP患者伴发炎症性肠病和其他自身免疫性疾病如类风湿关节炎、桥本甲状腺炎,皮肌炎、红斑狼疮以及自身免疫性血小板减少症。这些相关性其实并非偶然,它反映了一种发生自身免疫性疾病的遗传易感性。然而,病例对照研究并没有发现任何证据表明BP患者自身免疫性疾病的高风险。
创伤、烧伤、放疗或UV照射(包括PUVA)可以是一些BP患者的发病诱因。BP也可与某些皮肤病伴发,如银屑病、扁平苔藓。大疱可局限在银屑病的斑块上,推测真皮表皮交界处的慢性炎症导致了抗原暴露于自身反应性T细胞,引起继发性的免疫反应(表位扩展现象)。
最后,BP患者还可伴发神经系统疾病,如多发性硬化症、Shy-Drager 综合征或肌萎缩侧索硬化症。这些相关性的意义还不清楚。然而,值得注意的是在中枢和外周神经系统有BP230神经元变体的表达。
药物引起的大疱性类天疱疮
有些病人,BP可由于系统用药引起。涉及的药物很多,包括利尿药(如呋塞米、布美他尼)、镇痛药(如非那西丁)、D-青霉胺、抗生素(如阿莫西林、环丙沙星)、碘化钾、金和卡托普利。以一些药物(如呋塞米)作药物激发试验, 已观察到BP皮损的复制,但是,在诊断BP时,同时能记录下归咎药物的很少。有一个病例对照研究,比较了BP发病前长期使用的药物,发现BP病人比对照组使用利尿剂和精神安定药更为频繁。有的利尿剂是醛固酮类拮抗剂,可能会增加BP发生的风险。因此,对所有BP病人必须详细询问用药史,以排除药物诱发的可能,因为及时停药可使疾病很快好转。
药物引起BP的机制有待阐明。在有遗传易感性的人,药物可能通过改变免疫反应或改变表皮基底膜的抗原性而诱发疾病。
诊断和鉴别诊断
BP的诊断依靠典型的临床表现、组织学特点,最重要的是直接和间接免疫荧光(immuNOfluorescence,IF)显微镜的阳性所见。IF显微镜所见能为大多数疱病病例的正确分类提供充分和必要的线索。然而,特别是间接免疫荧光阴性的病例,还需作免疫化学研究(如下),以证明自身免疫反应的靶抗原是BP180和/或BP230。在疾病早期或非典型患者,尚无充分发展的大疱性皮损,诊断就得依靠直接免疫荧光的阳性结果和靶向自身抗原的特征。(见表1)
光镜和电镜
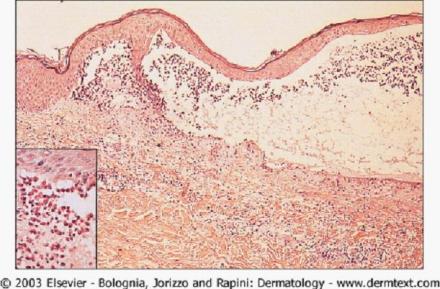
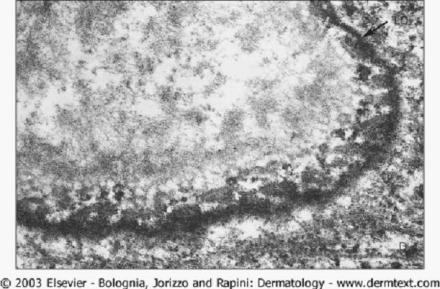
在BP的非大疱期或不典型患者,光镜仅能看到表皮下裂隙和嗜酸性粒细胞性海绵水肿,很少能提供特异的信息。在早期水疱的活检标本,典型所见为表皮下疱、真皮上层嗜酸性粒细胞和单一核细胞的炎症浸润。水疱内有纤维蛋白网和数量不等的炎症细胞浸润(图6),电镜显示形成的表皮下疱在透明板水平。表皮下疱,真皮和疱腔内由嗜中性粒细胞和嗜酸性粒细胞组成的炎性浸润。插入的图片(高倍放大)显示多数嗜酸性粒细胞的浸润。
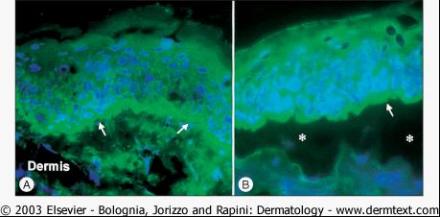
A 病损周围皮肤的直接免疫荧光显微镜检查可见沿表皮基底膜带(箭头)有线状连续的IgG沉积。在瘢痕性类天疱疮和获得性大疱性表皮松解症可见到相同的标记模式。B 利用盐裂的正常人皮肤为底物作间接免疫荧光显微镜检查。BP病人血清中的IgG自身抗体能与裂隙(箭头)的表皮侧(顶)结合。人为分离的水平由星号所示。在一组瘢痕性类天疱疮病人中可见到相同的标记模式。细胞核染为蓝色。免疫荧光显微镜
在几乎所有的病人中,皮损周围未受累皮肤的直接免疫荧光显微镜检查,可见特征性沿表皮基底膜(BMZ)连续、细线状IgG和/或C3(以及比较少见的其他Ig类别)的沉积(图7A),IgG4和IgG1是主要的IgG亚类。仔细分析BMZ的线状荧光模式(N锯齿状与U锯齿状模式),以及用1M NaCl处理过的病损周围皮肤(即盐裂皮肤)作 IF,有助于鉴别BP与其他自身免疫性大疱病。BP患者的免疫沉积物在盐裂皮肤的表皮侧(顶部)或在同时在表皮侧和真皮侧。尽管不能作为常规,但计算机辅助荧光重叠抗原图(fluorescence overlay antigen mapping,FOAM)技术可以更精确地确定免疫反应物沉积的位置。
在60%—80%病人的循环中可检测到抗基底膜带抗体IgG, 以及少见的IgA 和IgE 类抗体。这些自身抗体常结合于盐裂正常人皮肤的表皮侧,及少见的表皮和真皮两侧(图7B)。对间接免疫荧光检查,底物要选择盐裂的正常人皮肤,而不是完整的正常人皮肤或猴舌。最后,如果有条件,以皮肤作底物,或以缺乏诸如BP180或VII型胶原特异性基底膜蛋白的角质形成细胞系为底物,测试循环中的自身抗体,可以精确地确定它们的反应模式。
免疫电镜
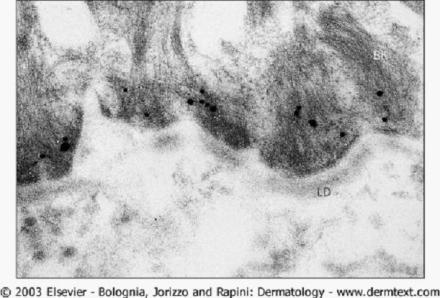
免疫电子显微镜并不能广泛使用,用金标记法已证明体内IgG抗体沉积主要在半桥粒下基底细胞膜的外侧,与BP180胞外域的定位是一致的。通过间接免疫电镜,发现针对BP230和BP180的自身抗体分别结合在半桥粒斑(图8)和半桥粒下透明板水平。
免疫化学研究
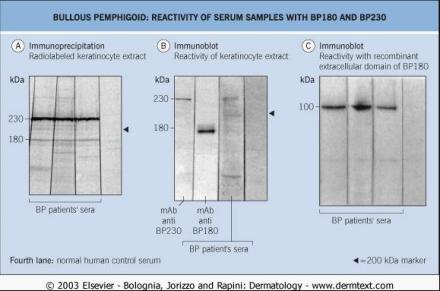
在角质形成细胞提取物的免疫印迹和免疫沉淀研究中,60%–100%病人血清中有能与180kDA 和/或230kDa分子结合的自身抗体,它们分别对应BP180和BP230(见表1; 图9A,B)。病人血清也常有特异的IgA和 IgE自身抗体。在原核系统或真核系统(如杆状病毒)表达的BP180和 BP230重组蛋白,正逐渐应用于检测自身抗体(图9C)。用包被了BP抗原特定域(如BP180 的NC16A域和BP180或BP230的C末端)的重组蛋白行酶联免疫吸附试验(Enzyme-linked immunosorbent assays,ELISAs),已发现是检测自身抗体相当特异(>90%)的方法。在未选择的BP患者中进行这个试验,其总体敏感性可能比得上以盐裂皮肤为底物的间接IF。与免疫印迹相比,ELISA所测的抗原是在天然条件下,因此与构象抗原的结合活性没有丢失。ELISA检测目前有商品化的产品,能快速鉴定患者血清的反应特性。由于BP患者非水疱期的临床表现缺乏特异性,可以与许多皮肤病相似,包括药物反应、接触性皮炎,痒疹(单纯和结节性),荨麻疹性皮炎及过敏性荨麻疹性反应、血管炎、节肢动物虫咬反应和疥疮。通常,根据病史、临床表现、病理特点以及最重要的IF显微镜检查结果可以鉴别。张力性大疱有时也可见于大疱性节肢动物虫咬皮炎、过敏性接触性皮炎、Stevens–Johnson 综合征、大疱性药疹、汗疱疹、假性卟啉症或迟发性皮肤卟啉症。在儿童,还需与大疱性脓疱病、遗传性大疱性表皮松解症及大疱性肥大细胞增生症作鉴别。
根据特征性的免疫病理所见和临床表现,BP可与天疱疮、副肿瘤性天疱疮及疱疹样皮炎相鉴别。最近的研究发现,表皮下疱患者,在表皮基底膜有IgG或C3的线状沉积,具备以下四个临床指标的,强烈提示BP的诊断:
没有皮肤萎缩
没有粘膜受累
没有头颈部受累
年龄大于70岁。
然而,将BP与以下自身免疫性的表皮下疱病鉴别有时具有挑战性(见表1)
获得性大疱性表皮松解症(epidermolysis bullosa acquisita,EBA)临床表现多样(见下)。虽然EBA经典的“非炎症型”有其临床特点,但“炎症型”与BP的临床表现极为相似。与BP患者相同,粘膜也可受累。
线状IgA大疱性皮病(Linear IgA bullous dermatosis,LABD)不是一个单一的病,它代表了一组表皮下大疱病。LABD皮疹在成人呈多形性,在儿童,除有生殖器和口周的皮损外,还常有环形和多环形的皮损。后者皮损也常出现在儿童BP患者。
瘢痕性类天疱疮(cicatricial pemphigoid,CP)是一种多相性的疾病,共同点是粘膜受累为主,病程慢性,有形成瘢痕的倾向(见下)。皮肤损害仅见于25%—30%的CP患者,常累及头部及躯干上部。若患者同时有口腔和皮肤的损害,CP与BP的区分较难。受累粘膜部位明显的瘢痕和有限的皮肤损害支持CP的诊断,有时鉴别要依靠免疫荧光的结果(见表1)。还有一小组病人,特点与BP相似,但循环中的自身抗体是针对表皮基底膜带的特定抗原,包括大约200kDa的蛋白(抗p200类天疱疮)和105 kDa的蛋白(抗p105类天疱疮),他们的归类还需作进一步的研究。
初始(Incipiens)类天疱疮.老年人,全身瘙痒,伴或不伴皮损,在循环中存在抗表皮基底膜带的自身抗体,且是针对BP180和/或BP230的,但常规IF显微镜检查为阴性。这是一个很困扰的问题。这些老年人中,有一部分最初的直接IF为阴性,最终发展为BP,可以认为患有初始类天疱疮。对这些患 者作早期治疗,可能会影响本病的临床过程。
疾病预后
BP病程慢性,可以自发的加重或缓解。由于顽固的瘙痒、大疱、糜烂或脓疱疮样皮损,本病患者常有明显的病态,严重的影响生活质量。尽管大多数病人在治疗后可得到临床缓解,但在老年患者中还是有相当的死亡率。发病第一年的死亡率在10%-40%间。年龄和Karnofsky评分<40(范围0-100)者显著影响预后。患者同时患的其他疾病和治疗的方式(皮质激素和/或免疫抑制剂的系统应用)也可能影响整个病情和死亡率。
基于ELISA试验,最近证明患者血清中抗BP180的IgG和IgE自身抗体水平与疾病的严重程度有相关性。此外,与BP180 NC16A域和C末端均有反应性的IgG抗体与一种粘膜易受累BP的特殊临床表型有关。然而,这些ELISA结果用于指导治疗的实际价值尚需进一步验证。
疾病治疗
BP的治疗基本上是基于临床经验,而非对照研究(表2和3)。
最普遍使用的是系统用皮质类固醇。对皮损泛发的病人,口服泼尼松0.5–1mg/kg/日,通常可以在1-2周内控制病情,然后在6-9个月内逐渐减量。然而,老年人使用皮质类固醇常伴发显著的不良反应,如高血糖、感染、骨质疏松、充血性心力衰竭等。最近,一个大样本的对照研究强调了局部应用强效皮质类固醇不仅对限局性或轻型BP有效,并且似乎在泛发性BP患者中与口服皮质类固醇具有相同的效力,最重要的是其系统的不良反应更少。偶尔,为了迅速控制病情,必要时可采用甲泼尼松龙冲击疗法。
免疫抑制剂的应用还有争议。一些临床医生在单独使用皮质类固醇不能控制病情、或患者有使用皮质类固醇的禁忌症时,倾向于将它们作为二线治疗药物。最常用的是硫唑嘌呤、甲氨碟呤、苯丁酸氮芥(0.1mg/kg/日,通常4–6mg/日),环磷酰胺
“CP表型”病人两个最常受累的部位是口腔粘膜和眼结合膜。除了这两个部位外,本病可始于、并累及任何粘膜部位,包括外生殖器粘膜、肛门、上呼吸消化道粘膜和/或食道。大约85%病人有口腔粘膜受累(通常无皮肤损害)。口腔可能是活动病变的唯一部位。损害通常累及齿龈、颊粘膜和上颚;牙槽嵴、舌和唇则不常受累。牙龈缘的红斑和糜烂(脱屑性或糜烂性牙龈炎)
结膜受累是常见的,可以导致失明。结膜常是CP的唯一受累部位。多数病例开始为单侧,以后累及双眼。最初为非特异的慢性结膜炎,自觉烧灼感、酸痛感、异物感,有黏液的分泌,病程中病情加重和缓解,最终进展为上皮下结膜纤维化。
在睑结合膜罕见水疱或大疱。慢性炎症可导致进行性的瘢痕形成,包括下穹隆变浅和睑球粘连。(如在眼球和睑结膜间形成的纤维束;图12)。结膜的纤维化导致倒睫和睑内翻。如果疾病没有得到控制,倒睫、睑内翻和干燥症(由于泪道的瘢痕形成)可导致浅表角膜的创伤、角膜的新生血管化,继而发生角膜的溃疡,并致失明。
鼻咽部粘膜的受累常慢性,并且伴发上呼吸道广泛的损害,最终形成溃疡结痂、鼻衄、相邻粘膜表面的纤维粘附和气道阻塞。咽部粘膜的受累表现为咽后壁和侧壁的溃疡及吞咽困难。喉粘膜的受累可能造成严重后果,可出现声音嘶哑、失语,甚至发生危及生命、需作气管插管的气道阻塞。
由于食道粘膜的糜烂可导致了吞咽困难,但病变也可以完全无症状。一些病人慢性的炎症导致食道狭窄,继而发生吞咽困难和体重下降。
生殖器和肛门粘膜的受累较为罕见,早期皮损为水疱和慢性糜烂。女性病人进展的病变可引起萎缩性瘢痕和阴道口狭窄。男性病人的包皮和龟头间形成粘连。肛门受累也能造成瘢痕形成,严重的病例可形成狭窄。
皮肤损害
25%–30% CP患者有皮肤损害。最常累及头皮、面部、颈部和躯干上部。皮损常表现为红斑块,这些部位易反复发生水疱和糜烂,继而形成萎缩性的瘢痕。(图13)。皮损数目通常有限。然而,也有类似BP的泛发皮损及愈后不留瘢痕的病例报道。
诊断和鉴别诊断
光镜和电镜
多数CP病人的组织病理学特点和BP类似。完整水疱的标本可见水疱在表皮下或上皮下(没有棘层松解),主要由数量不等单一核细胞的混合类型细胞浸润。陈旧的皮损多在真皮上部有纤维化。口腔损害,炎症细胞浸润中常有浆细胞。受累结膜上皮则常有包括单核细胞和肥大细胞的炎症细胞浸润,在粘膜下可见肉芽组织。
对新发水疱的电镜检查发现表皮真皮的裂隙发生在透明板内,这与在BP所见的相同。在进展期有瘢痕的结膜损害中,致密板呈不连续性、中心增厚或重叠。
免疫荧光显微镜
通过直接免疫荧光显微镜观察,80%–95%的CP病人体内结合有针对粘膜和/或皮肤基底膜带的自身抗体。大多数病人病损周围的活检标本显示沿表皮基底膜带连续、细线状的IgG和/或C3沉积(见图7)。值得注意的是,粘膜直接免疫荧光检查阳性率(50%–90%)比皮肤标本(20%–50%)要高。沉积的IgG主要属于IgG4和IgG1亚类。IgA和IgM的线状沉积较少见。盐裂皮肤的直接免疫荧光显微镜检查在CP中诊断价值较低。经常是同时有表皮侧和真皮侧荧光沉积的混合模式,偶可见到仅有表皮侧或仅有真皮侧的荧光。间接免疫荧光检查,约20%-30%CP病人的血清中可以检测到抗基底膜带抗体。抗体主要是IgG,但IgA及更少见的IgM自身抗体也可检测到。抗体的滴度通常很低。最近的研究发现抗体滴度较高,且同时存在循环IgG和IgA抗基底膜带抗体CP患者的病情更严重。以正常口腔粘膜或生殖道粘膜及结膜为底物,或用盐裂皮肤为底物,可增加间接免疫荧光检查的敏感性。采用盐裂皮肤作底物,大多数CP病人的循环抗体结合在表皮侧(见图7),抗层粘连蛋白5 CP患者的IgG循环抗体结合在真皮侧。使用盐裂的口腔粘膜作底物并不能提高敏感性。以基因敲除的皮肤作底物(如某基底膜蛋白缺乏的底物)或FOAM技术(见上)作间接免疫荧光检查,能将抗表皮整联配体蛋白CP(抗层粘连蛋白5)与EBA区分开。
免疫电子显微镜
CP的直接免疫电镜研究发现免疫沉积物分布或是在透明板下半部及致密板或是在半桥粒上或周围,其中大多数沉积在浆膜下基底层角质形成细胞的外侧。通过间接免疫电镜观察,自身抗体常结合在透明板下半部与致密板的交界处,在半桥粒的下面和侧面(图14)。尽管电镜研究不能作为常规,并且耗时长,但是,在不能用传统IF方法证明组织中有免疫反应物的沉积时,如最近在一部分眼CP患者中所描述的,电镜对确立这些病人CP的诊断是极为有用的。免疫化学研究
免疫化学技术,特别是免疫印迹和免疫沉淀,已证明在具有CP表型患者中自身靶抗原是异源性的。循环中的自身抗体与表皮基底膜带各种蛋白如层粘连蛋白5、BP180发生结合(见表1)。这些靶抗原成为了CP不同临床亚型的血清标记(见上)。
CP患者通常存在抗BP180胞外域的IgA自身抗体。在某些病例中,这些自身抗体优先与蛋白水解分割或脱落的BP180胞外域,即线状IgA大疱病抗原(见第32章)上的抗原反应位点结合。已经报道的其他靶抗原,包括168kDa抗原(在颊粘膜有高表达)和某些仅有眼部CP病人的45kDa抗原。然而,对这些发现还需要进一步的研究和确定。
以在细菌或真核表达系统中表达的重组蛋白或亲和纯化的天然蛋白(如BP180、层粘连蛋白5)为底物,采用ELISA检测CP病人循环中自身抗体是很有用的,具有很高的敏感性和特异性,并且对CP的预后也有指导意义。
鉴别诊断
对皮损主要累及粘膜,表现为水疱或糜烂,和受累组织IF检查显示有沿表皮基底膜带线状、连续的免疫反应物沉积的患者,都需要考虑CP的诊断。CP与其他表皮下自身免疫性大疱病(包括BP、EBA和线状IgA大疱性皮病)的鉴别非常困难,通常需要复杂的免疫病理研究(见上)。相反地,与寻常性天疱疮和非自身免疫性大疱性皮肤病的鉴别则较为容易,根据组织病理和常规IF检查一般可资鉴别。
当口腔损害是唯一表现时,临床上,CP难以与寻常性类天疱疮或糜烂性LP区分。CP晚期,结膜的瘢痕性损害可与以下疾病相似:严重的慢性感染性结膜炎、由于眼科制剂(包括毛果芸香碱、碘苷、胍乙啶、β受体阻滞剂)导致的眼部假性类天疱疮、Stevens-Johnson综合征和中毒性表皮坏死松解症的晚期。罕见的、有泛发皮损的CP则与BP难以鉴别。总之,以粘膜损害为主,伴有瘢痕的病人应优先考虑CP的诊断.
疾病预后
CP是一种特别慢性、具有潜在毁损性、但很少致死的疾病。最重要的并发症是眼部受累导致视觉受损。CP也可以导致体重下降、呼吸系统、性器官和泌尿系统的并发症。即使疾病限局,CP对生活质量也有很大的负面影响。由于严重的喉部、气管或食道病变,出现危及生命的并发症是很罕见的。抗层粘连蛋白5CP患者发生实体器官肿瘤,特别是腺瘤的相对风险增大。
疾病治疗
CP患者的治疗取决于病情的程度和严重性,这要根据多学科对受累组织的详细评估,治疗很困难,并且通常令人沮丧。CP的治疗计划主要依靠临床实践。
局部治疗是很重要的,在某些病例,可足以控制病情。局部外用强效皮质类固醇对轻中度活动性疾病可取得满意的疗效。局部外用皮质类固醇(如漱口药或局部外用凝胶或咬合剂),合并四环素漱口液和良好的口腔卫生,对口腔的皮损有效。皮质类固醇的喷雾剂和吸入剂对治疗鼻腔、咽部或食道病变有效。对皮肤和粘膜的难治性损害,可通过皮损内局部注射皮质类固醇得到改善。食道狭窄需作扩张术,以防止吞咽困难和体重下降。在严重气管受累的病人,需行气管插管术以防止窒息。
系统治疗的指征为严重的眼部、喉部或食管受累,以及局部治疗无效的口腔或皮肤损害。氨苯砜(50–150mg/日)是控制口腔和皮肤损害的一线治疗,也可用于轻度的眼部CP患者。环磷酰胺(1-2mg/kg/日)是对迅速进展或严重眼部疾病的治疗选择,可单独,或与口服皮质类固醇联合使用,或用冲击疗法。这些治疗对缓解严重的结膜炎症,预防复发和防止瘢痕形成是有效的。有报告使用硫唑嘌呤(2mg/kg/日)有助于部分控制CP的眼部病变和皮肤损害。用药剂量应当根据硫代嘌呤甲基转移酶的水平进行调整。
通常,仅仅系统服用皮质类固醇治疗CP是不够的,它们治疗粘膜损害比皮肤损害效果要差。对有显著食道或喉支气管受累的病人,应当积极治疗,联合给予泼尼松和环磷酰胺,以防止可能危及生命并发症的发生。对治疗CP可能有效的其他疗法,包括磺胺吡啶、米诺环素,和四环素与烟酰胺的联合用药、局部外用他克莫斯、局部或系统用环孢素、沙利度胺和结膜下注射丝裂霉素。最新的研究提示IVIG或甲氨蝶呤有助于控制进展性的眼部病变。
对累及眼、喉、食道或生殖器的严重瘢痕形成,必要时需手术治疗。当然,手术应当在药物完全控制了病情(静止期)后进行。对眼部病变,外科的干预措施包括角膜移植、同种异体的睑板移植、羊膜移植和睑缝合术。