-
肌球蛋白 编辑
依据来源,可以将肌球蛋白分为两类:传统的肌球蛋白和非传统的肌球蛋白。传统的肌球蛋白指那些构成肌肉的肌球蛋白,也就是肌球蛋白Ⅱ,最早发现于动物细胞的肌肉组织和细胞质中,主要为肌肉收缩提供驱动力,能够把ATP水解释放出来的化学能转化为肌肉收缩的机械能。但是非肌肉细胞中也存在肌球蛋白Ⅱ,称为非肌肉肌球蛋白Ⅱ。非传统的肌球蛋白指的是那些肌肉中不含有的肌球蛋白,如肌球蛋白I、Ⅲ、ⅣV、V,等只存在于非肌肉细胞之中;肌球蛋白VⅢ,Ⅺ和xⅡ只存在于植物当中。
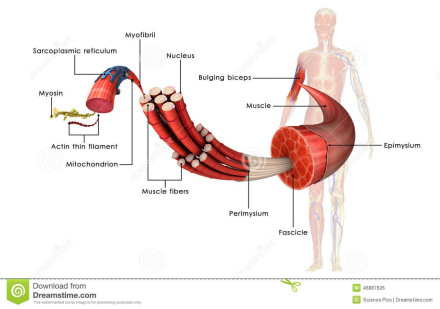
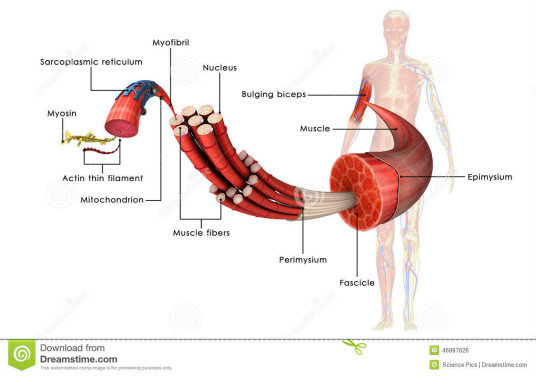
不管肌球蛋白的来源如何,其基本结构是由一条或两条重链和几条轻链组成。在一般情况下,肌球蛋白是由三个结构域:马达域,颈部和尾部构成。
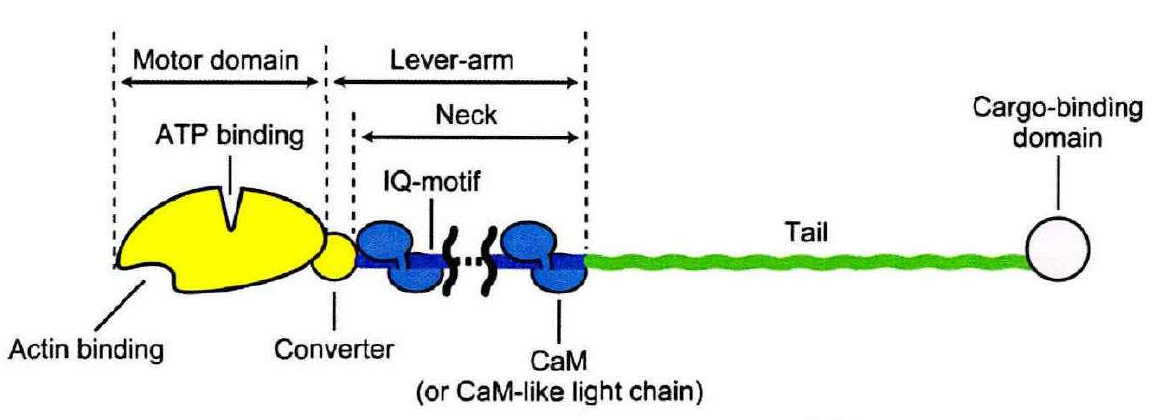 肌球蛋白域结构示意图
肌球蛋白域结构示意图
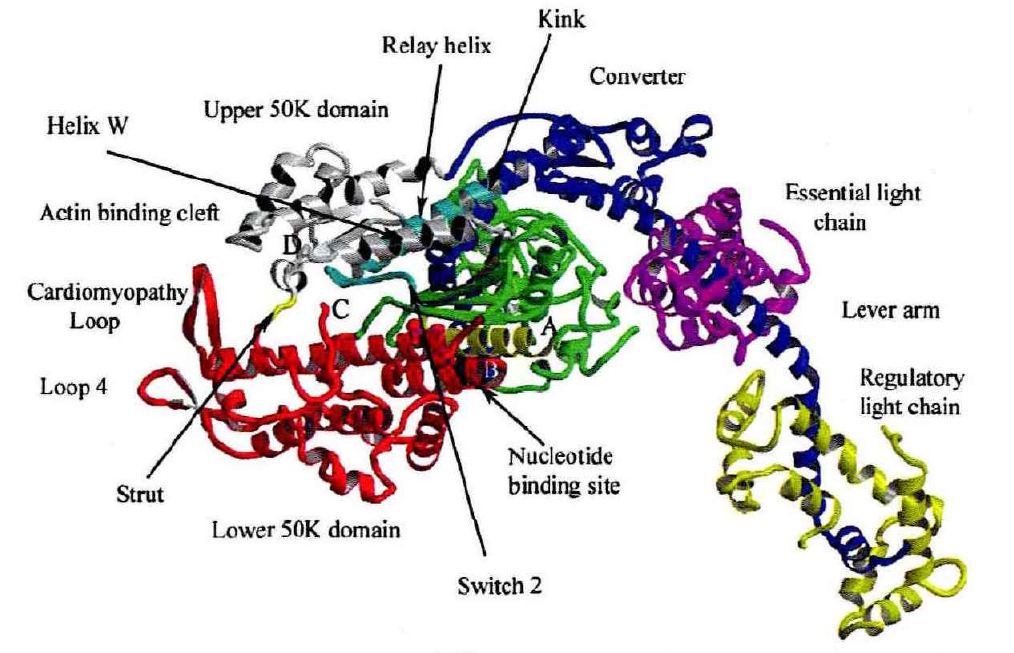
马达域
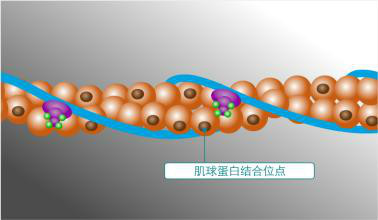
肌球蛋白的头部,分子量为80kDA,通常位于氨基末端。在所有的肌球蛋白种类中,马达域的核心序列是高度保守的。不同的肌球蛋白马达域的结构是非常相似的,由多个α螺旋包围的7个β折叠链组成。马达域包含两个重要的结合位点:核苷酸结合位点和肌动蛋白结合位点。肌动蛋白结合位点被深裂口分开,根据ATP的结合与否而开或关。ATP结合位点由一个P环构成,类似于驱动蛋白,说明肌动蛋白和驱动蛋白的运动有一个相似的与ATP有关的构象变化机制。
 肌球蛋白马达域的结构。绿色为氨基端,深蓝色为缓基端。
肌球蛋白马达域的结构。绿色为氨基端,深蓝色为缓基端。
颈部
肌球蛋白的颈部由一个长的α螺旋构成,携带1到6个特有的IQ模体。这些IQ模体有致的钙调蛋白结合序列(QXXXRGXXXR),每个IQ模体都含有一个钙调蛋白或钙调蛋白家族成员的结合位点,颈部区域通过结合钙调蛋白或相关的轻链而得以稳定,且能够传导和放大马达域受ATP影响的构象变化,在ATP水解后,产生动力冲程,所以有时颈部也被称为杆臂。不同的肌球蛋白,颈部长度不同。肌球蛋白Ⅴ颈部比较长,约24mm,大约是肌球蛋白Ⅱ的3倍长
尾部
肌球蛋白的尾部通常位于羧基末端,是一个超螺旋结构,其序列、长度、域成分和组织极其易变。肌球蛋白之间最本质的区别在于球状尾部。尾部含有为不同的“货物”提供的特定结合位点。这一结构域通过直接作用或通过接头蛋白来识别各种“货物”,决定肌球蛋白的细胞定位(靶向)和功能。
性质
肌球蛋白属球蛋白类,不溶于水而溶于0.6mol/ml的KCl或NaCl溶液。它具有酶活性,通过与肌动蛋白相互作用,水解ATP的末端磷酸基团,同时也能水解GTP、CTP等,将化学能转化为机械能,从而产生各种形式的运动。物理化学研究表明,肌球蛋白溶液加入ATP后,其粘度和流动双折射显著下降。后来证实这是由于肌动蛋白与肌球蛋白复合物的分解,形成两种轴比较小的蛋白质分子而引起。
功能
肌球蛋白作为细胞骨架的分子马达,是一种多功能蛋白质,其主要功能是为肌肉收缩提供力。纤丝滑动学说(sliding filament theory)认为肌肉收缩是由于肌动蛋白细丝与肌球蛋白丝相互滑动的结果。在肌肉收缩过程中,粗丝和细丝本身的长度都不发生改变,当纤丝滑动时,肌球蛋白的头部与肌动蛋白的分子发生接触(attachment)、转动(tilting),最后脱离(detachment)的连续过程,其结果使细丝进行相对的滑动。