-
NF-κB 编辑
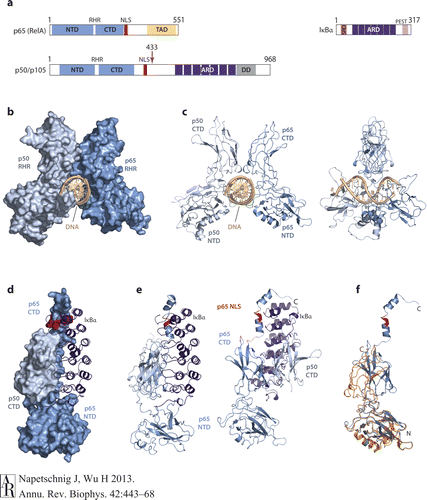
NF-κB结合DNA的结构最早是在成熟B细胞免疫球蛋白κ-轻链基因的增强子上被发现,两个亚基形成的同源和/或异源二聚体与靶基因上10bp特定的序列(-κB 位点)结合调节基因转录,不同的NF-κB二聚体在选择结合序列时可能略有差异,这是NF-κB通过不同的二聚体的形式对不同基因的表达进行精细调节的一种方式,但结合的模式基本相同。NF-κB的两个RHR组装成蝴蝶样结构,中间有一个孔可以让DNA穿过。CTD负责两个蛋白的二聚,以及DNA的磷酸化,NTD可以特异性识别DNA碱基序列以及非特异性结合DNA的磷酸骨架。
最常见的NF-κB二聚体是RelA(p65)与 p50组成的异二聚体。
NF-κB二聚体的抑制蛋白家族(IκB)包含传统的IκB蛋白(IκBα,IκBβ,IκBε),NF-κB前体蛋白(p100,p105),以及核IκB(IκBζ , Bcl-3, and IκBNS)。
IκB通过其C末端特定的锚蛋白重复序列(ankyrin repeat–containing domain ,ARD)与NF-κB结合,并覆盖NLS阻止NF-κB向细胞核内转移。
由于在其C末端半部存在锚蛋白重复,p105和p100也起IκB蛋白的作用。p100的c-末端一半(通常称为IκBδ)也起抑制剂的作用。IκBδ响应发育刺激而降解,例如通过LTβR转导的刺激,在NIK依赖的非经典途径中加强NF-κB二聚体活化。
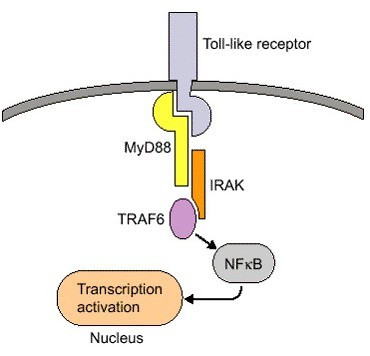
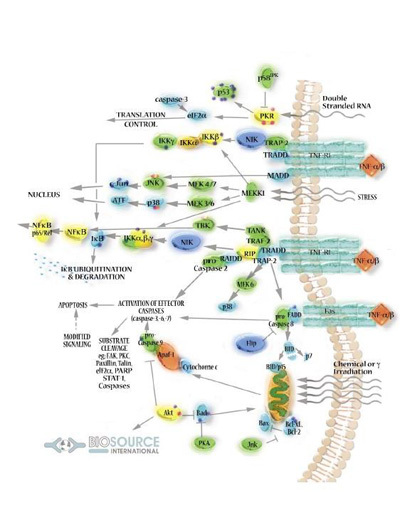
NF-κB信号通路是由细胞外的刺激引起的。细胞外信号因子与细胞膜上的受体结合,开启了一连串下游的反应。受体蛋白接受刺激后先活化IκB激酶(IKK)。IKK将细胞内NF-κB·IκB复合物的IκB亚基调节位点的丝氨酸磷酸化,使得IκB亚基被泛素化修饰,进而被蛋白酶降解,从而释放NF-κB二聚体。自由的NF-κB会进入细胞核,与有NF-κB结合位点的基因结合,启动转录进程。NF-κB也会激活IκBα基因的表达,新合成的IκBα重新抑制NF-κB的活性,从而形成了自发负反馈环,这样的设计原理将形成NF-κB振荡的现象。
NF-κB在调节细胞反应中是相当重要的,因为它属于“快速作用”的初级转录因子,不需要新的蛋白质合成就能被激活(有该特性的其他成员包括c-Jun,STAT和核激素受体)。NF-κB是对有害细胞刺激的第一反应者。已知的NF-κB通路激活因子有很多,包括:TNF-α、IL-1β、IL-2、IL-6、IL-8、IL-12、iNOS、COX2、趋化因子、粘附分子、集落刺激因子等。此外,锌指蛋白A20、血红素加氧酶-1 (HO-1)等一些抗炎和与细胞凋亡有关的分子如:肿瘤坏死因子受体相关因子-1(tumour-necrosis factor receptor associated factor -1,TRAF-1),抗细胞凋亡的蛋白-1和-2(inhibitor of apoptosis 1/2 , IAP1/ IAP2),TNF 受体相关因子(receptor–associated factors ,TRAF1 /TRAF2),Bcl-2 同源体 A1/Bfl-1和 IEX-IL也都受NF-κB的调控。
NF-κB受体激活剂(RANK)是一种TNFR,是NF-κB的中枢激活剂。骨保护剂(OPG)是RANK配体(RNAK ligand,RANKL)的诱饵受体同系物,通过结合RANKL来抑制RANK,因此骨保护素与NF-κB的调控紧密相关。
许多细菌的代谢产物和各种表面受体的活化导致NF-κB通路的激活,快速改变基因的表达。Toll样受体(Toll-like receptors,TLRs)作为一种特殊的识别分子,它对NF-κB通路的激活增加了我们对不同病原体激活NF-κB通路的理解。TLR是先天性和适应性免疫应答的关键调节因子。