-
组蛋白修饰 编辑
组蛋白结构请参考词条组蛋白
H3·H4 的乙酰化可打开一个开放的染色质结构,增加基因的表达。转录共同激活物如CBPöP300、PCA F 实质上是体内的组蛋白乙酰基转移酶(histone Acetyitransferases; HATs)。相反,组蛋白去乙酰化酶(histone deacetylases,HDACs)参与组成转录共同抑制复合物,已发现的两个共同抑制复合物SIN3、M i22NHRD(核小体重塑蛋白去乙酰基酶) 都含有HDAC1、HDAC2。S IN 3 的组成为核心(HDAC1、HDAC2、RBA P46öRBA P48) + S IN 3AöS IN 3B、SA P30öSA P18共同构成。S IN 3 复合物通过组分S IN 3A 与序列特异性转录因子或共同抑制物包括mael2max,核激素受体N 2CORöSMRT、甲基化CPG 粘附蛋白(NECP2、MBD2)相互作用。
Mi22NHRD 由核心(HDAC1、HDAC2、RBA P46öRBA P48) + M i2、M TA 1öM TA 2、MBD3 组成,其中MBD3 含有MBD 样序列,与甲基化DNA 有低亲和力,分析发现MBD3 与甲基化有关的氨基酸被置换,由此推测MBD3 与MBD2 相互作用而使M i22NURD 与甲基化DNA 结合。由此看出,DNA 甲基化和组蛋白去乙酰化协同作用共同参与转录阻遏。此外,M i22NURD 还有染色质重塑活性,所以S IN 3 和M i22 NURD 可能分别在长期和短期转录阻遏调节中起作用。
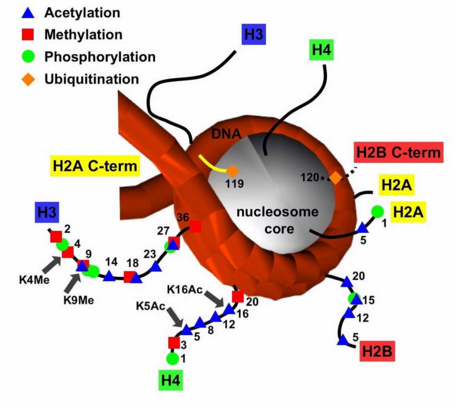
在哺乳动物基因组中,组蛋白则可以有很多修饰形式.。一个核小体由两个H2A,两个H2B,两个H3,两个H4组成的八聚体和147bp缠绕在外面的DNA组成. 组成核小体的组蛋白的核心部分状态大致是均一的,游离在外的N-端则可以受到各种各样的修饰,包括组蛋白末端的乙酰化,甲基化,磷酸化,泛素化,ADP核糖基化等等,这些修饰都会影响基因的转录活性。
组蛋白的甲基化修饰:
组蛋白被甲基化的位点是赖氨酸和精氨酸。赖氨酸可以分别被一、二、三甲基化,精氨酸只能被一、二甲基化。在组蛋白H3上,共有5个赖氨酸位点可以被甲基化修饰。一般来说,组蛋白H3K4的甲基化主要聚集在活跃转录的启动子区域。组蛋白H3K9的甲基化同基因的转录抑制及异染色质有关。EZH2可以甲基化H3K27,导致相关基因的沉默,并且与X-Chromosome inaCTivation相关。H3K36的甲基化同基因转录激活相关。
⒈甲基化
组蛋白甲基化是由组蛋白甲基化转移酶(histonemethyl transferase,HMT)完成的。甲基化可发生在组蛋白的赖氨酸和精氨酸残基上,而且赖氨酸残基能够发生单、双、三甲基化,而精氨酸残基能够单、双甲基化,这些不同程度的甲基化极大地增加了组蛋白修饰和调节基因表达的复杂性。甲基化的作用位点在赖氨酸(Lys)、精氨酸(Arg)的侧链N原子上。组蛋白H3的第4、9、27和36位,H4的第20位Lys,H3的第2、l7、26位及H4的第3位Arg都是甲基化的常见位点。研究表明·,组蛋白精氨酸甲基化是一种相对动态的标记,精氨酸甲基化与基因激活相关,而H3和H4精氨酸的甲基化丢失与基因沉默相关。相反,赖氨酸甲基化似乎是基因表达调控中一种较为稳定的标记。例如,H3第4位的赖氨酸残基甲基化与基因激活相关,而第9位和第27位赖氨酸甲基化与基因沉默相关。此外,H4—K20的甲基化与基因沉默相关,H3—K36和H3—K79的甲基化与基因激活有关。但应当注意的是,甲基化个数与基因沉默和激活的程度相关。
⒉乙酰化
组蛋白乙酰化主要发生在H3、H4的N端比较保守的赖氨酸位置上,是由组蛋白乙酰转移酶和组蛋白去乙酰化酶协调进行。组蛋白乙酰化呈多样性,核小体上有多个位点可提供乙酰化位点,但特定基因部位的组蛋白乙酰化和去乙酰化是以一种非随机的、位置特异的方式进行。乙酰化可能通过对组蛋白电荷以及相互作用蛋白的影响,来调节基因转录。早期对染色质及其特征性组分进行归类划分时就有人总结指出:异染色质结构域组蛋白呈低乙酰化,常染色质结构域组蛋白呈高乙酰化。最近有研究发现,某些HAT复合物含有一些常见的转录因子,某些HDAC复合物含有已被证实的阻遏蛋白。这些发现支持了高乙酰化与激活基因表达、低乙酰化与抑制基因表达有关的看法。
⒊组蛋白的其他修饰方式
相对而言,组蛋白的甲基化修饰方式是最稳定的,所以最适合作为稳定的表观遗传信息。而乙酰化修饰具有较高的动态,另外还有其他不稳定的修饰方式,如磷酸化、腺苷酸化、泛素化、ADP核糖基化等等。这些修饰更为灵活的影响染色质的结构与功能,通过多种修饰方式的组合发挥其调控功能。所以有人称这些能被专识别的修饰信息为组蛋白密码。这些组蛋白密码组合变化非常多,因此组蛋白共价修饰可能是更为精细的基因表达方式。
另外,研究发现H2B的泛素化可以影响H3K4和H3K79的甲基化,这也提示了各种修饰间也存在着相互的关联。
最新研究结果显示:球形组蛋白修饰模式可预测低分级前列腺癌的复发危险。结果发表在《自然》杂志上。该研究第一作者加利福尼亚大学的Siavash K. Kurdistani表示:这种修饰模式最终可作为前列腺或其他类型癌症的预后或诊断指标,也可作为预测何种患者会对一类组蛋白去乙酰酶抑制剂新药产生反应的指标。
Kurdistani解释:某些组蛋白修饰模式会在一定水平上影响基因的表达,但具体机制尚不清楚。Kurdistani等人研究了五种组蛋白修饰模式,包括三种乙酰化作用,两种二甲基化作用,用组织芯片技术对原发前列腺癌组织样品中的组蛋白修饰水平进行检测。研究者对104例Gleason评分小于7的样本进行染色组蛋白修饰检测,结果将研究对象分为两组,第一组十年内复发危险为17%,第二组为42%。该预测指标与肿瘤分期,术前PSA水平或是否包膜外侵犯相独立。研究者对另外的39例低分级前列腺癌样本的组蛋白修饰模式进行了确认,结果也分为两组,一组的复发危险为4%,另一组为31%。
研究者最后表示:考虑到组蛋白修饰模式的多样性,其他组蛋白修饰位点的信息将有助于我们对患者进行进一步分类,包括那些高分极组的患者。应用免役组化及越来越多的的抗体检测组蛋白修饰将有助于这种检测指标在其他肿瘤中的应用。
基因表达是一个受多因素调控的复杂过程.组蛋白是染色体基本结构-核小体中的重要组成部分,其N-末端氨基酸残基可发生乙酰化、甲基化、磷酸化、泛素化、多聚ADP糖基化等多种共价修饰作用.组蛋白的修饰可通过影响组蛋白与DNA双链的亲和性,从而改变染色质的疏松或凝集状态,或通过影响其它转录因子与结构基因启动子的亲和性来发挥基因调控作用.组蛋白修饰对基因表达的调控有类似DNA遗传密码的调控作用.
在引起基因沉默的过程中,沉默信号(DNA甲基化、组蛋白修饰、染色质重新装配)是如何进行的?谁先谁后?这是一个“鸡和蛋”的问题,目前仍处于研究阶段,还没有定论。研究发现DNA甲基化和组蛋白甲基化是一个相互促进、加强的过程,如许多HDAC可以和DNMTl、3a、3b相互作用;而甲基化CpG结合蛋白— 2(methylcytosinebindingprotein—2,MeCP—2)又可以和HDAC相互作用。这种作用方式提示着这两种方式中任何一种的存在都可以引起另一种修饰方式的起始。
沉默信号如何进行?它们发生的顺序如何?早期的研究多来源于对非哺乳动物生物的研究。Tamaru在链孢霉属(Neurospora)CTaSSa中研究发现,H3K9组蛋白甲基化转移酶的突变,会引起DNA甲基化的丢失,这暗示着组蛋白甲基化可以起始DNA甲基化。Tariq在Arabidopsis中研究也发现,CpNpG甲基化依赖于组蛋白甲基化。以上证据都暗示着,组蛋白甲基化对DNA甲基化有指导作用。
然而在哺乳动物细胞中,这种现象还有待于进一步研究。早期研究发现,体外甲基化的CpG片段稳定整合到哺乳动物基因组中以后,可以与含甲基化CpG结合结构域(methylbindingdomain,MBD)蛋白(包括MeCP—1和MeCP—2等)结合,进而可以招募包括HDAC的抑制复合物。进一步研究还发现,人MLH基因的甲基化可以引发特异的组蛋白密码组合,以保持基因沉默状态。研究者通过使用DNA甲基化酶抑制剂5—氮杂胞苷(5—Aza),而不使用组蛋白乙酰化酶抑制剂制滴菌素A(trlcoSTATmA,TSA),可以导致组蛋白甲基化修饰方式的缺失。从这些结果可以看出,在哺乳动物中,组蛋白修饰似乎又是DNA甲基化发生以后的事件。但Bachman在哺乳动物中敲除p16基因时发现,染色质修饰并不完全依赖于最初的DNA甲基化。同时,Mutskov和Felsenfeld的结果也支持了这个理论,他们认为组蛋白修饰是ILR2基因沉默的早期事件,启动子区的甲基化是一个逐步增加的过程,DNA甲基化的建立是为了长期维持基因沉默,而不是起始它。
从以上的结果可以看出,表观遗传学过程是复杂的和多层面的,不同的表观遗传修饰也可能存在区域或信号途径的特异性,有很多未知的东西有待于进一步研究。