-
心肌细胞 编辑
根据它们的组织学特点、电生理特性以及功能上的区别,可以粗略地分为两大类型,两类心肌细胞分别实现一定的职能,互相配合,完成心脏的整体活动。
工作细胞
一类是普通的心肌细胞,包括心房肌和心室肌,含有丰富的肌原纤维,执行收缩功能,故又称为工作细胞。工作细胞不能自动地产生节律性兴奋,即不具有自动节律性;但它具有兴奋性,可以在外来刺激作用下产生兴奋;也具有传导兴奋的能力,但是,与相应的特殊传导组织作比较,传导性较低。自律细胞
另一类是一些特殊分化了的心肌细胞,组成心脏的特殊传导系统;其中主要包括P细胞和浦肯野细胞,它们除了具有兴奋性和传导性之外,还具有自动产生节律性、兴奋的能力,故称为自律细胞,它们含肌原纤维甚小或完全缺乏,故收缩功能已基本丧失。还有一种细胞位于特殊传导系统的结区,既不具有收缩功能,也没有自律性。只保留了很低的传导性,是传导系统中的非自律细胞,特殊传导系统是心脏内发生兴奋和传播兴奋的组织,起着控制心脏节律性活动的作用。
2.心肌细胞的细胞核多位于细胞中部,形状似椭圆或似长方形,其长轴与肌原纤维的方向一致。肌原纤维绕核而行,核的两端富有肌浆,其中含有丰富的糖原颗粒和线粒体,以适应心肌持续性节律收缩活动的需要。从横断面来看,心肌细胞的直径比骨骼肌小,前者约为15微米,而后者则为100微米左右。从纵断面来看,心肌细胞的肌节长度也比骨骼肌的肌节为短。
3.在电子显微镜下观察,也可看到心肌细胞的肌原纤维、横小管、肌质网、线粒体、糖原、脂肪等超微结构。但是心肌细胞与骨骼肌有所不同;心肌细胞的肌原纤维粗细差别很大,介于0.2~2.3微米之间;同时,粗的肌原纤维与细的肌原纤维可相互移行,相邻者又彼此接近以致分界不清。心肌细胞的横小管位于Z线水平,多种哺乳动物均有纵轴向伸出,管径约0.2微米。而骨骼肌的横小管位于A-I带交界处,无纵轴向伸出,管径较大,约0.4微米。心肌细胞的肌质网丛状居中间,侧终池不多,与横小管不广泛相贴。
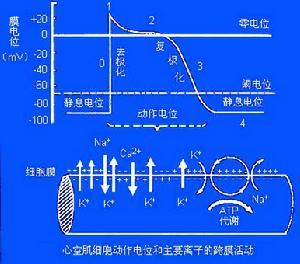
心肌细胞生物电产生的基础:心肌细胞跨膜电位取决于离子的跨膜电-化学梯度和膜对离子的选择性通透。
跨膜电位
心室肌细胞跨膜电位及其产生机理
1.静息电位:心室肌细胞在静息时,细胞膜处于外正内负的极化状态,其主要由K+外流形成。
2.动作电位:心室肌动作电位的全过程包括除极过程的0期和复极过程的1、2、3、4等四个时期。
0期:心室肌细胞兴奋时,膜内电位由静息状态时的-90mV上升到+30mV左右,构成了动作电位的上升支,称为除极过程(0期)。它主要由Na+内流形成。1期:在复极初期,心室肌细胞内电位由+30mV迅速下降到0mV左右,主要由K+外流形成。
2期:1期复极到0mV左右,此时的膜电位下降非常缓慢它主要由Ca2+内流和K+外流共同形成。
3期:此期心室肌细胞膜复极速度加快,膜电位由0mV左右快速下降到-90mV,历时约100~150ms。主要由K+的外向离子流(Ik1和Ik、Ik也称Ix)形成。
4期:4期是3期复极完毕,膜电位基本上稳定于静息电位水平,心肌细胞已处于静息状态,故又称静息期。Na+、Ca2+、K+的转运主要与Na+--K+泵和Ca2+泵活动有关。关于Ca2+的主动转运形式,当前,多数学者认为:Ca2+的逆浓度梯度的外运与Na+顺浓度的内流相耦合进行的,形成Na+-Ca2+交换。
蒲肯野细胞的跨膜电位及产生机理
蒲肯野细胞的动作电位及其产生机理与心室肌细胞基本相似,但其有4期自动除极化。4期自动除极化是膜对Na+通透性随时间进行性增强(If内向电流)的结果。If通道与快Na+通道的主要区别是:①If的通道对离子的选择性不强,虽然主要选择的是Na+,但还有K+参与。而快Na+通道的选择性强,主要允许Na+通透。②If的通道在复极达-60mV左右被激活,而快Na+通道在膜内电除极达-70mV左右被激活。③If的通道可被铯(Cs)所阻断,而快Na+通道可被河豚毒阻断。
窦房结P细胞跨膜电位及产生机理
1.P细胞动作电位的主要特征4期膜电位不稳定,可发生自动除极,这是自律细胞动作电位最显著的特点。
此外:
1)除极0期的锋值较小,除极速度较慢,约为10V/s,0期除极只到0mV左右。2)复极由3期完成,基本没有1期和2期。
3)复极3期完毕后进入4期,这时可达到的最大膜电位值,称为最大舒张电位(或称最大复极电位),约为-70mV。
心肌细胞
2.P细胞动作电位的形成及离子流的活动
(1)0期除极的形成:0期除极的内向电流主要是由钙离子负载的。
(2)3期复极的形成:0期除极后,慢钙离子通道逐渐失活。3期是由钙离子内流和钾离子外流共同作用的结果。
(3)4期自动除极的形成:当前研究与三种离子流有关。
A:钾离子外流的进行性衰减;
B:钠离子内流的进行性增强;
C:生电性Na+--Ca2+离子交换。
心肌细胞的电生理学
生物电分类
心肌细胞的电生理学分类
心肌细胞除了解剖生理特点分为工作细胞(非自律细胞)和自律细胞外,还可根据心肌细胞动作电位的电生理特征(特别是0除极速率),把心肌细胞所产生的动作电位分为两类:快反应电位和慢反应电位,而把具有这两不同电位的细胞分别称为快反应细胞和慢反应细胞:
1.快反应细胞包括:心房肌、心室肌和蒲肯野细胞,其动作电位特点是:除极快、波幅大、时程长。
2.慢反应细胞包括窦房结和房室交界区细胞,其动作电位特点是:除极慢、波幅小、时程短。
心肌细胞分类小节如下:
自律细胞
快反应自律细胞:如蒲肯野氏细胞
慢反应自律细胞:窦房结和房室交界区(房结区,结希区)细胞
非自律细胞快反应非自律细胞:心房肌、心室肌细胞
慢反应非自律细胞:结区细胞
美国科学家在《自然》(Nature)杂志上发表研究报告指出,发现了一组可培植心肌细胞的干细胞。带领这项研究的科学家正是华人WilliamPu。美国麻省波士顿儿童医院的研究人员表示,新发现的干细胞位于心脏最外层的心外膜,或能修复已受损害的心脏组织。WilliamPu称:“当病人心脏出现问题时,便会失去驱动心跳的心肌细胞。补救方法就是制造更多这类细胞。”据悉,研究人员是在偶然的情况下发现新干细胞的。他们当时正在研究心外膜的另一组基因,所以要在活老鼠的胚胎上,用红色荧光蛋白复合体标签特定的细胞。出乎意料之外,他们竟然目睹心外膜细胞转化成心肌细胞。WilliamPu的研究成果显示,用基因编号为“Wt1”的干细胞能制造出心肌细胞、滑肌细胞及内皮细胞。心肌细胞肥大
心肌组织包括心肌细胞和间质两部分,其中心肌细胞占心脏总体积的75%;间质占25%。心肌细胞肥大是指心肌细胞体积增大直径增宽或长度增加和肌节数量增多,心肌过度肥大时可有心肌细胞增生。
细胞学基础
心肌细胞是一种高度分化的终末细胞,其收缩蛋白以α-肌球蛋白(α-MHC)为主,主管收缩功能。收缩蛋白包括肌球蛋白,肌动蛋白、向肌球蛋白及向宁蛋白。其中肌球蛋白包括2个重链(MHC)、2个轻链(MLC),心脏仅有两种MHC基因表达即α-MHC和β-MHC形成α-α、β-β同二聚体及α-β异二聚体,分别形成同功酶V1、V2及V3。正常情况下,胚胎心房及成人心房α-MHC即V1同功酶占优势,而左右心室从胚胎到成人β-MHC始终保持在80%~90%,以V3同功酶占优势。心肌细胞一般不能增殖,只有细胞体积的肥大,处于收缩状态。胚胎期心肌细胞来源于肌干细胞,经肌母细胞逐渐分化成成熟的心肌细胞,其收缩蛋白以β-MHC占优势,处于“合成状态”,心肌肥大是心肌细胞从成熟的“收缩状态”向“胚胎型合成状态”转化的一种现象。心肌细胞肥大时,其表型变化,体积增大,心肌细胞内收缩蛋白类型改变,同时也可有心肌间质细胞增殖。心肌细胞和间质细胞的生长有各自的调控机制,心肌细胞肥大可伴有也可不伴有间质细胞的增殖。
原因和机制
1958年Teare对肥厚性心肌病进行了描述,从此,人们一直对心肌肥厚的发生机制进行研究,研究表明心肌肥厚是一种复杂的多种因素参与调节的动态过程。心肌细胞肥大发生的生化基础是心肌蛋白合成的增加,导致细胞体积的增加。各种机械刺激,化学因素作用都可导致心肌肥大。
1.机械性刺激的直接作用 长期的压力和/或容积负荷过度。使心室壁应力增加,导致心肌肥大。整体实验表明心脏受到负荷刺激时可发生心肌肥大。机械性刺激可通过促进蛋白质合成增加或/和促使蛋白质降解减少而导致心肌肥大。其机制为(1)细胞内CAMP增加在搏动或停搏的心脏,其主动脉压从7.98kPa(60mmHg)升至15.96kPa(118mmHg)时,其蛋白质合成增加,核蛋白形成增多,CAMP含量增多及CAMP依赖性蛋白激酶活性增加,提示动脉压力增高可通过CAMP依赖性作用机制加速蛋白质合成。(2)细胞内肌醇磷酯增加Portzer等报告,主动脉狭窄造成左室肥大时,肥大心肌的细胞浆蛋白激酶(PKC)活力较对照增加15%,细胞膜PKC活力增加40%。说明心肌牵张增加心肌内肌醇磷酯含量的原因可能是由于磷脂酶C的激活。(3)原癌基因表达增加 在压力负荷过重所致心肌肥大早期,可观察到原癌基因表达增加。(4)肌动蛋白和肌球蛋白基因表达增加 培养的心肌细胞持续受到牵张刺激时,其β-MHC和α-肌动蛋白的基因表达增加。(5)其它 心肌细胞间钙离子通道,钠离子内流及细胞内环境碱性比等均可在牵张刺激所致的心肌肥厚中起重要调节作用。
2.化学性刺激 体液因素亦可促进细胞的肥大或增殖。(1)去甲肾上腺素(NE),动物实验证明,长期注射亚高血压剂量的NE可诱发心肌肥大,这种心肌肥大可能主要通过α1-R起作用,亦有学者将NE加入心肌细胞培养液中发现myc基因转录可见增加5~10倍,并促进心肌肥大,这一反应可被特异性α1受体拮抗剂所阻断可为蛋白激酶C、活化剂PNA所加强,提高NE是通过α-受体、激活磷脂酰肌醇,蛋白激酶C系统,激活癌基因表达起作用的。(2)雄激素Cabral等在大鼠去压力感受器神经后诱发的神经源性高血压中发现,雄性大鼠左室重量/体重比值明显高于雌性,给睾酮可引起类似雄性神经源性高血压大鼠的左室心肌肥厚,而给予雌二醇则可抑制左室重量增加,其机理尚不清,可能与癌基因有关。(3)血管紧张素Ⅱ(AngⅡ)AngⅡ受体分AT1与AT2两亚型,AT1受体与心肌的正性变力和变时作用及心肌细胞的生长肥大有关将AngⅡ加入心肌细胞培养液中,c-fos、c-jun、c-mye等原癌基因表达迅速加强,并促使蛋白质合成增加,诱导心肌肥大。AngⅡ还可引起血管紧张素原基因和转化生长因子β1基因上调,进而促使心肌细胞肥大,这一反应可被AngⅡAT1受体阻断剂阻断,亦可被PKC加强,提示AngⅡ是通过AT1受体激活磷酸肌醇酯—蛋白激酶C系统,激活原癌基因表达的。(4)内皮素(ET)1988年由Yangisawa等从猪主动脉内皮细胞分离出一种缩血管多肽。ET是通过与靶细胞上ET受体结合,发挥作用,调节细胞增殖的。ET受体分为ETA、ETB、ETC,心血管肌细胞富含ETA,ETA所致心肌肥大,可能是通过增加肌球蛋白的轻键2、α-肌动蛋白、肌钙蛋白及α、β肌球蛋白重链mRNA的表达。有人报道ETA也可能在体内NE导致的心肌肥大中起作用。(5)生长激素(GH)及胰岛素类生长因子(TGF)Antonio等人观察了GH及TGF1对大鼠心血管系统的影响,发现心肌为GH及IGF-1的靶器官,给予正常成年人大鼠外源性GH及IGF-1,可致其心肌肥大。容量和压力负荷的增加,可使心脏IGF-1的基因表达增强。GH和IGF-1也可能间接通过胰岛素代谢或肾上腺素系统起作用。(6)白细胞介素6(IL-6)与细胞肥大因子(CT-1)keiko等人发现心肌细胞在缺氧,再灌注及受到其它因子刺激时,可分泌大量IL-6,且与心肌肥大有关。IL-6作为配体,与IL-6受体结合后,使与其相连的GP130形成同型二聚体,这样酪氨酸激酶被活化,Ras-Paf-map激酶等一系列反应随之发生,促进细胞基因转录活性增高。CT-1是从小鼠胚胎干细胞分化诱导期的上清液中分离出来的分子量为21.5KDA的蛋白质。有人报道:心肌细胞同样产生CT-1,也通过GP130影响细胞内传导信息的。CT-1刺激心肌细胞肥大的作用比AngⅡ和ET还强,CT-1亦可使心肌细胞c-fos、c-jun及ANP、mRNA表达增多,说明CT-1调节细胞基因活化和转录水平。
在国外,心肌细胞电生理学的著作,日益增多,而在国内,则寥寥无几,而为临床医生所读的著作,更是缺如。
鼠心肌细胞的培养和分离
目的
建立心肌细胞培养模型,用于心肌细胞体外实验。
方法
采用胰酶消化及新生大鼠心肌细胞与非心肌细胞如成纤维细胞、血细胞等的差时贴壁法分离提纯心肌细胞,建立心肌培养模型。
结果
心肌细胞培养最长成活时间达3天,心肌细胞受消化时间的影响有不同的形态表现。
结论
可以利用差时贴壁法分离新生鼠心肌细胞并在体外进行培养,胰酶消化以低浓度短时间为佳。
材料
1.心肌细胞的消化
取一只加盖烧杯,内放一块用乙醚饱和的纱布,把0~3日龄的大鼠幼鼠放进该烧杯中麻醉,用2%碘酒和75%酒精消毒胸腹皮肤,在无菌条件下开胸取出心脏,立即置于4ºCD-Hanks液(mmol/L:Nacl137,Kcl5.4,Na2HPO40.37,K2HPO40.44,NaHCO34.2)中剪取心室肌,洗净残血,剪成约1mm³大小的组织块,弃去D-Hanks液加入0.08%胰蛋白酶液10~15ml,于37°C静置5min,吸出上层悬液,并加入等量的含血清培养基。经终止消化后离心(1800r/min)弃上清液,加入含血清的培养液。吹散沉淀细胞,同条件下离心,用10%血清培养液制成细胞悬液,置于37°C含5%CO2培养箱中。
心肌细胞分离
根据心肌细胞和非心肌细胞贴壁时间的不同采用2小时差速贴壁,分别获得心肌成纤维细胞和心肌细胞。心肌细胞按1*106个细胞/ml种于50ml培养液中,培养的前2天在心肌细胞培养液中加入5-溴脱氧嘧啶核苷0.1mmol/l,以抑制非心肌细胞增殖,所有培养的心肌细胞均每2天换液一次。
1.3心肌细胞的无血清培养
当心肌细胞培养24小时后换无血清培养液(含DMEM培养液,胰岛素10g/ml,铁蛋白10g/ml,维生素C100g/L维生素B121.5µmol/L)继续培养48小时,每隔8小时换液一次,尽量保持各添加成分浓度不变,最后收集细胞,进行测定。
2.实验结果
本次实验中新生大鼠心肌细胞培养最长存活时间为3天。实验采取低浓度,短时间胰蛋白酶消化的方法。消化时间不同,所得到的细胞有不同的形态变化:消化3~5分钟,高倍镜下观察心肌细胞大部分呈新月形,并可见细胞在培养液中呈头尾相连的过程,呈动态变化。而消化5~10分钟的心肌细胞卷曲呈圆形,密度低,活动能力差。细胞培养约8小时后向一处聚集,彼此钩连呈现高密度区,这可能与细胞之间形成连接有关。由于某种不明原因,多次培养过程中心肌细胞中都出现不明微生物,致使细胞在3天后基本死亡。
3.实验讨论
有很多文献报道新生大鼠心肌细胞的培养时间为10~12天,本次实验的培养时间为3天,与之比较成活时间较短,但本实验可以说明低浓度胰蛋白酶消化液(0.08%)比一般浓度(0.125%)的消化时间效果好,消化时间在3~5分钟内可减少细胞死亡率.实验过程中出现的细胞向一处聚集的现象和可见的连续的形态变化,可以说明体外培养心肌细胞重新连接成更大单位细胞团是可能的,它们可能通过形态的变化相互钩连,连接成网。