-
甲烷 编辑
中文名:甲烷
外文名:methane
别名:碳烷
化学式:CH₄
CAS登录号:74-82-8
EINECS登录号:200-812-7
熔点:-182.5℃
沸点:-161.5℃
密度:0.42(-164℃)(标准情况)0.717g/L
外观:常温下为无色无气味气体
闪点:-188℃
安全性描述:S9;S16;S33
危险性符号:R12
UN危险货物编号:1971
分类:链状脂肪烃(GB/T37885-2019)
发现:20世纪40年代首次发现空气中存在甲烷
在今天的大气中,有大约20%的甲烷来自古代,是在几百万年前就存在于煤层、海底、天然气矿藏和融化了的永久冻土下面而到今天才释放出来的。而近代产生的甲烷,来源主要有牛、泥沼、沥青、稻田、新开垦的土地、腐败的垃圾和白蚁等。无论哪种来源,都是由细菌在缺氧条件下进行的有机物分解,若是有氧则会产生CO2 。
在正常气压下,甲烷的爆炸下限(LEL)为5-6%,爆炸上限(UEL)为15-16%;甲烷在空气中的浓度达到9.5%时,就会发生最强烈的爆炸。其中,氧浓度降低时爆炸下限变化不大,而爆炸上限明显降低;当氧浓度低于12%时,混合气体就失去爆炸性 。
(2)甲烷可与氯气发生取代反应
CH3Cl+Cl2 CH2Cl2+HCl
CH2Cl2+Cl2 CHCl3+HCl
CHCl3+Cl2 CCl4+HCl
(3)可火焰燃烧和催化燃烧
CH4+2O2 CO2+2H2O
催化剂一般贵金属催化剂中使用Pd基催化剂、Pt基催化剂、Au基催化剂或Pd-Pt、Pd-Rh、Pd-Au和Pd-Pt-Rh等多组分贵金属催化剂。
非贵金属催化剂有金属氧化物催化剂、钙钛矿催化剂、尖晶石催化剂和六铝酸盐催化剂等。
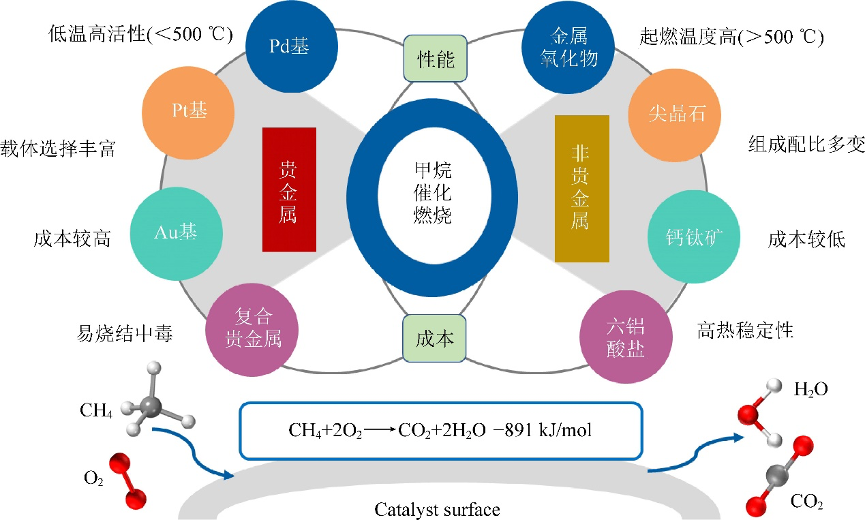 用于甲烷催化燃烧的贵金属和非贵金属催化剂
用于甲烷催化燃烧的贵金属和非贵金属催化剂
实验室制甲烷
CH3COONa CH3·+·COONa
CH3·+NaOH CH4+·ONa
·ONa+CH3COONa CH3·+Na2CO3
CH3·+CH3COONa CH3COCH3+·ONa
CH3·+CH3· C2H6
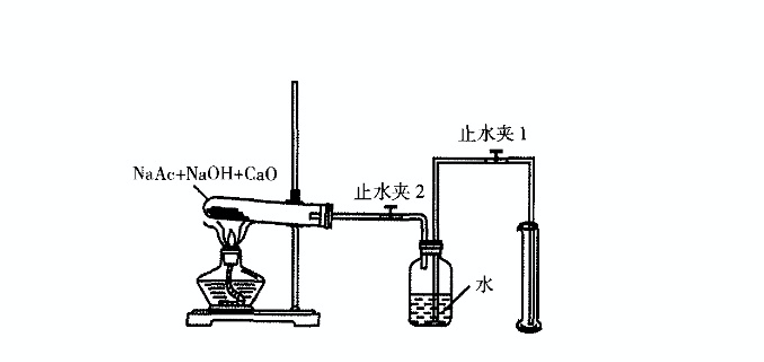 实验装置
实验装置
煤转化生成甲烷
Coal CO+H2
CO+H2O CO+H2
CO+H2 CH4+CO2+H2O
煤炭热解生成甲烷
(1)机理
煤样直接一次热解与活泼H*生成甲烷:Coal-CH3+H* Coal+CH4
前期热解生成液态产物的二次热解也是生产甲烷的途径之一。
原煤:分为四个阶段。
第一阶段属于吸附甲烷的脱除。
第二阶段有两种反应共同作用生成,分别是甲氧基中甲基的脱落,生成二氧化碳和甲烷或醇类官能团中甲基的脱落,生成甲烷和水。
第三阶段甲苯热解生成甲烷和苯,其次是亚甲基桥键断裂和氢化芳香环的脱甲基反应。
第四阶段是芳香体系脱H与残余的C反应的结果。
直接转化制高值化学品
(1)甲烷氧化偶联制乙烯(OCM)
1982年,KELLER等 首次报道了甲烷氧化偶联制C2烃的反应过程。1985年,DRISCOLL等 首先提出OCM遵循异相和均相反应相结合的反应机理。甲烷的C—H键首先被催化均裂生成气相甲基自由基,然后偶联为乙烷,乙烷进一步在催化剂上或气相中脱氢转化为乙烯。LUO等采用同步辐射真空紫外光电离质谱(SVUV-PIMS)技术首次在线检测到Li-MgO催化甲烷和乙烷氧化反应中的气相甲基自由基、乙基自由基、过氧甲基自由基、甲基过氧化氢和乙基过氧化氢等重要气相中间体,为OCM和乙烷氧化脱氢反应的机制研究提供了直接的实验证据。
(2)甲烷无氧芳构化制芳烃(MDA)
1993年,WAng等 报道了Mo/ZSM-5催化甲烷无氧芳构化制苯等芳烃的反应,提出了双功能机理,即活性Mo物种和Brønsted酸位分别作为甲烷活化和C2烃芳构化的活性位,得到了广泛认可。但是,部分研究者认为活性Mo物种拥有固有芳构化特性,分子筛骨架为活性Mo位提供锚定位点,十元环的择形环境促进了芳烃的形成。2018年,KOSINOV等 的研究取得了突破性进展,并提出了“烃池机理”,即甲烷活化后的初级产物与分子筛限域的芳香型积炭发生二次反应,形成苯等芳烃。VOLLMER等 提出了类似的Mars-van-Krevelen机理(MvK),活性Mo位上含碳原子,该碳原子在反应中参与苯环的形成。ÇAĞLAYAN等 和KOSINOV等 认为MDA过程中存在两条独立的C—H键活化路径。
(3)甲烷无氧直接制乙烯
GUO等 采用HAADF-STEM、in situ XAS等技术表征研究表明,MTOAH反应中Fe©SiO2的活性位为单原子铁配位两个碳原子和一个硅原子形成的单铁中心(FeSiC2); XIE等 报道单原子Pt1@CeO2催化MTOAH过程 ,经DRIFTS研究结果显示,反应后Pt1@CeO2存在具有π键的乙烯和乙炔等吸附物种,这说明单Pt位可能具有稳定C2烃吸附物种的能力。EGGART等 采用火焰喷雾热解法(FSP)制备了Pt-CeO2单原子催化剂,operando XAS结果表明,在反应条件下Pt与Ce成键,归因于CeO2对Pt的包覆修饰或者Pt—Ce合金的形成。HAO等 采用氢原子里德堡标识飞行时间谱-交叉分子环化装置,首次在实验中检测到MTOAH过程产生的氢自由基,其形成速率随反应温度的增加而增加,还发现由1,2,3,4-四氢萘(THN)和苯等供氢分子热裂解产生的氢自由基可以提升甲烷转化率及烯烃和芳烃的收率,并降低乙烯形成的起活温度,由此提出了气相氢自由基促甲烷活化反应机制(·H + CH4→ H2 + ·CH3) 。
间接转化
通过重整生产合成气(一氧化碳和氢气混合气),合成气经甲醇路径、费托合成或新的OXZEO过程获得高值化学品。
(1)甲烷水蒸气重整(SRM)
CH4+H2O = CO+3H2……Δ Δ =206kJ·mol-1
(2)甲烷催化部分氧化(POM)
2CH4+O2 = 2CO+4H2……Δ Δ =-44·kJ·mol-1
(3)甲烷二氧化碳重整(CDM)
CH4+CO2 = 2CO+2H2……Δ Δ =+247 ·kJ·mol-1
(4)甲烷的CO2-O2联合重整
CO2-O2联合重整 CH反应是将甲烷催化部分氧化这一放热过程和甲烷二氧化碳重整这一吸热过程相结合来制备合成气。
时间 | 开发利用阶段 | 代表性瓦斯抽采模式 | 基本发展情况 |
20世纪50-70年代末 | 瓦斯抽放+防治阶段 | 以辽宁抚顺模式、山西阳泉模式和重庆天府模式为代表,分别形成了高透气高瓦斯特厚煤层瓦斯抽采技术、穿层钻孔邻近层卸压瓦斯抽采技术和高瓦斯突出煤层群保护层开采技术等 | 以矿井瓦斯灾害防治为目的,抽采瓦斯绝大部分直接排放至大气中 |
20世纪70年代末-90年代初 | 瓦斯抽采利用发展阶段 | 保护层卸压瓦斯抽采、低透煤层水力强化瓦斯抽采等技术不断推广,初步构建形成中国瓦斯综合抽采技术体系 | 瓦斯抽采技术不断发展,井下瓦斯抽采利用项目得到推进,高浓度抽采瓦斯开始用于工业和民用 |
20世纪90年代-21世纪初 | 瓦斯规模化抽采利用阶段 | 以安徽淮南模式为代表,形成复杂煤层群留巷钻孔法卸压瓦斯抽采技术体系 | 瓦斯抽采技术和模式进一步发展,瓦斯抽采逐渐形成规模化,抽采量和利用量均快速增加 |
2006-2021年 | 瓦斯资源化抽采利用阶段 | 以重庆松藻模式、山西晋城模式为代表,分别形成了“三区配套三超前增透抽采”与“三区联动煤层气(瓦斯)井上下立体递进抽采”模式等 | 瓦斯抽采技术和模式逐渐成熟,低浓度和超低浓度煤矿瓦斯的利用取得进展,瓦斯利用范围不断拓展 |
2021年以后 | 瓦斯资源化抽采与减排利用协同阶段 | 逐步构建形成“采前-采中-采后”煤炭开发全生命周期瓦斯抽采减排技术体系 | 强调对温室气体排放的管控,瓦斯抽采技术进一步向智能化、精准化方向发展;鼓励低浓度瓦斯和乏浓度瓦斯的综合高效利用,最终形成全浓度瓦斯阶梯式综合利用模式 |
(表格数据来源 )










