-
甲酸 编辑
中文名:甲酸
外文名:Formicacid
别名:蚁酸
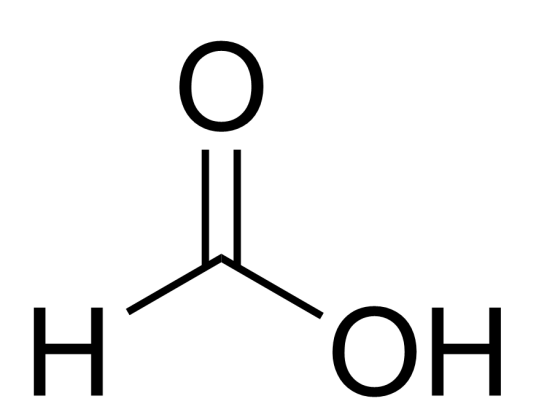
化学式:HCOOH或CH2O2
分子量:46.03
CAS登录号:64-18-6
EINECS登录号:200-001-8
熔点:8.2至8.4℃
沸点:100.6℃
密度:1.22g/cm³
外观:无色透明发烟液体,有强烈刺激性气味
闪点:69℃
安全性描述:S45;S26;S23;S36/37/39
危险性描述:R35
折射率:1.3714
MDL号:MFCD00003297
RTECS号:LQ4900000
BRN号:1209246
PubChem号:24873243
InChI:1S/CH2O2/c2-1-3/h1H,(H,2,3)
甲酸最早由J. -L. 盖-吕萨克用草酸分解制得。1855~1856年,M. 贝特洛用氢氧化钠与一氧化碳直接制得甲酸钠,T. 戈德-施密特最先用水解的方法从甲酸钠制得甲酸。此法于1896年在欧洲开始用于工业生产,至今小批量生产仍用此法。1980年,美国科学设计公司、伯利恒钢铁公司和利奥纳德公司开发成功甲醇羰基化生产甲酸的方法,并已有年产甲酸20千吨的工厂投产。此外,甲酸也可由轻质油氧化制醋酸的副产物中回收获得。
物理性质
能与水、乙醇、乙醚和甘油任意混溶,和大多数的极性有机溶剂混溶,在烃中也有一定的溶解性。
浓度高的甲酸溶液在冬天易结冰。
相对密度(20℃,4℃):1.220
燃烧热:254.4 kJ/mol
临界温度:306.8 ℃
闪点:68.9 ℃(开杯)
密度:1.22 g/cm3
饱和蒸气压(24 ℃):5.33 kPa
黏度(mPa·s, 25 ºC):1.966
黏度(mPa·s, 30 ºC):1.443
蒸发热(kJ/mol, 25 ºC):19.90
蒸发热(kJ/mol, b.p.):23.19
熔化热(kJ/mol):12.69
生成热(kJ/mol, 25 ºC, 液体):-425.04
比热容(kJ/(kg·K), 26.68 ºC,定压):2.15
热导率(W/(m·K), 15 ºC):13.9148
热导率(W/(m·K), 30 ºC):13.8456
热导率(W/(m·K), 60 ºC):13.7744
热导率(W/(m·K), 90 ºC):13.6033
辛醇/水分配系数的对数值:-0.54
爆炸上限(V/V):57.0%
爆炸下限(V/V):18.0%
分子结构
摩尔折射率:8.40
摩尔体积(cm3/mol):39.8
等张比容(90.2 K):97.5
表面张力(dyne/cm):35.8
极化率(10-24 cm3):3.33
在烃中及气态下,甲酸以通过以氢键结合的二聚体形态出现。在气态下,氢键导致甲酸气体与理想气体状态方程之间存在较大的偏差。液态和固态的甲酸由连续不断的通过氢键结合的甲酸分子组成。由于甲酸的结构特殊,它的一个氢原子和羧基直接相连。也可看做是一个羟基甲醛。
化学性质
1、甲酸的酸性
甲酸是脂肪酸中唯一在羧基上连有氢原子的酸,氢原子斥电子力量远小于烃基,使羧基碳原子的电子密度比其他羧酸低,又因共轭效应、羧基氧原子上的电子更偏向碳,所以甲酸的酸性,强于同系列中的其他羧酸。甲酸具有与大多数其他羧酸相同的性质,在通常情况下甲酸不会生成酰氯或者酸酐。甲酸在水溶液中是一元弱酸,酸度系数(pKa)=3.75(at 20℃),1%甲酸溶液pH值为2.2。
以下是甲酸酸性所体现的性质:
与碱反应
甲酸具有酸的性质,因此可以和碱发生中和反应,生成甲酸盐和水。
甲酸与氨水反应:HCOOH+NH3·H2O = =HCOONH4+H2O
甲酸与氢氧化钠:HCOOH+NaOH = HCOONa+H2O
甲酸与氢氧化铜:2HCOOH+Cu(OH)2 = Cu(HCOO)2+2H2O
甲酸与氢氧化钙:2HCOOH+Ca(OH)2 = Ca(HCOO)2+2H2O
与盐反应
甲酸与碳酸钠:2HCOOH+Na2CO3 = 2HCOONa+H2O+CO2↑
甲酸与碳酸钙:2HCOOH+CaCO3 = Ca(HCOO)2+H2O+CO2↑
与金属反应
由于弱酸的性质,对于许多金属,甲酸是有腐蚀性的,例如镁和锌,反应生成氢气和金属甲酸盐。
甲酸与钠反应:2HCOOH+2Na = 2HCOONa+H2↑
甲酸与锌反应:2HCOOH+Zn = Zn(COOH)2+H2↑
甲酸与镁反应:2HCOOH+Mg = Mg(COOH)2+H2↑
2、使高锰酸钾褪色
甲酸具有和醛类似的还原性,而酸性高锰酸钾有较强的氧化性,所以两者可以发生氧化还原反应,使高锰酸钾溶液褪色。
3、分解反应
4、银镜反应
甲酸为强还原剂,它能起银镜反应,把银氨络离子中的银离子还原成金属银,而自己被氧化成二氧化碳和水。
5、加成反应
甲酸是唯一能和烯烃进行加成反应的羧酸。甲酸在酸的作用下(如硫酸,氢氟酸),和烯烃迅速反应生成甲酸酯。但是类似于Koch反应的副反应也会发生,产物是更高级的羧酸。
6、酯化反应
甲酸能和醇类在浓硫酸的作用下并加热能发生酯化反应。如甲酸与甲醇在浓硫酸的催化下并加热,可发生酯化反应,生成甲酸甲酯。
7、还原反应
甲酸在催化剂的的作用下加氢可还原为甲醛。
8、甲酸完全燃烧
实验室制法
在无水丙三醇中加热草酸,后蒸汽蒸馏得到。
或在盐酸作用下水解异乙腈得到:
工业制法
1、甲酸钠法:一氧化碳和氢氧化钠溶液在160-200 ℃和2 MPa压力下反应生成甲酸钠,然后经硫酸酸解、蒸馏即得成品。
2、甲醇羰基合成法(又称甲酸甲酯法):甲醇和一氧化碳在催化剂甲醇钠存在下反应,生成甲酸甲酯,然后再经水解生成甲酸和甲醇。甲醇可循环送入甲酸甲酯反应器,甲酸再经精馏即可得到不同规格的产品。
3、甲酰胺法:一氧化碳和氨在甲醇溶液中反应生成甲酰胺,再在硫酸存在下水解得甲酸,同时副产硫酸铵。原料消耗定额:甲醇31 kg/t、一氧化碳702 kg/t、氨314 kg/t、硫酸1010 kg/t。
4、以甲酸钠与浓硫酸作用制得工业级甲酸,然后可用活性炭吸附后减压蒸馏以制得纯品。
5、二氧化碳法:在钯络合物催化下,在三乙胺水溶液中,二氧化碳与氢气于140~160 ℃反应而得。
精制方法
1.无水甲酸可在减压下直接分馏制得,分馏时用冰水冷却凝结。对含水甲酸,可用无水硫酸铜做干燥剂。对试剂级88%的甲酸,可用邻苯二甲酸酐回流6小时后蒸馏的方法除去其中的水分。进一步纯化可利用分步结晶法。甲酸与乙酸混在一起时,可加入脂肪烃进行共沸蒸馏分离。
2.将甲酸与五氧化二磷混合,进行减压蒸馏,反复5-10次,方可得到无水甲酸,但得量低,费时长,会造成一些分解。将甲酸与硼酸醉进行蒸馏,操作简便,效果更好。将硼酸置甩沪中高温脱水至不再产生气泡,所得熔融物倒在铁片上,置干燥器中冷却,然后研磨成粉。将硼酸酚细粉加到甲酸中,放置几日,形成硬块,分出清彻液体进行减压蒸馏,收集22-25 ℃/12-18 mm馏份为产品。蒸馏器应是全磨口接头并有干燥管保护。
甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。甲酸可直接用于织物加工、鞣革、纺织品印染和青饲料的贮存,也可用作金属表面处理剂、橡胶助剂和工业溶剂。在有机合成中用于合成各种甲酸酯、吖啶类染料和甲酰胺系列医药中间体。具体分类如下:
1、医药工业:可用于咖啡因、安乃近、氨基比林、氨茶碱、可可碱冰片、维生素B1、甲硝唑、甲苯咪唑的加工。
2、农药工业:可用于粉锈宁、三唑酮、三环唑、三氨唑、三唑磷、多效唑、烯效唑、杀虫醚、三氯杀螨醇的加工。
3、化学工业:制造各种甲酸盐、甲酰胺、季戊四醇、新戊二醇、环氧大豆油、环氧大豆油酸辛酯、特戊酰氯、脱漆剂、酚醛树脂的原料。
4、皮革工业:用作皮革的鞣制剂、脱灰剂和中和剂。
5、橡胶工业:用于天然橡胶凝聚剂的加工,橡胶防老剂的制造。
6、实验室制取CO。化学反应式:
8、检定铈、铼和钨。检验芳香族伯胺、仲胺和甲氧基。测定相对分子质量和结晶的溶剂甲氧基。显微分析中用作固定剂。
9、甲酸及其水溶液能溶解许多金属、金属氧化物、氢氧化物及盐,所生成的甲酸盐都能溶解于水,因而可作为化学清洗剂。甲酸不含氯离子,可用于含不锈钢材料的设备的清洗。
10、用于调配苹果、番木瓜、菠萝蜜、面包、干酪、乳酪、奶油等食用香精及威士忌酒、朗姆酒用香精。在最终加香食品中浓度约为1~18 mg/kg 。
疏水参数计算参考值(XlogP):-0.2
氢键供体数量:1
氢键受体数量:2
可旋转化学键数量:0
互变异构体数量:0
拓扑分子极性表面积(TPSA):37.3
重原子数量:3
表面电荷:0
复杂度:10.3
同位素原子数量:0
确定原子立构中心数量:0
不确定原子立构中心数量:0
确定化学键立构中心数量:0
不确定化学键立构中心数量:0
共价键单元数量:1
健康危害
主要引起皮肤、粘膜的刺激症状。接触后可引起结膜炎、眼睑水肿、鼻炎、支气管炎,重者可引起急性化学性肺炎。浓甲酸口服后可腐蚀口腔及消化道粘膜,引起呕吐、腹泻及胃肠出血,甚至因急性肾功能衰竭或呼吸功能衰竭而致死。皮肤接触可引起炎症和溃疡。偶有过敏反应。
急救措施
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
误食:用水漱口,给饮牛奶或蛋清。就医。
皮肤接触:立即脱去被污染衣着,用大量流动清水冲洗,至少15分钟。就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。
泄漏处理
迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿防酸碱工作服。不要直接接触泄漏物。尽可能切断泄漏源。防止流入下水道、排洪沟等限制性空间。
小量泄漏:用砂土或其它不燃材料吸附或吸收。也可以将地面洒上苏打灰,然后用大量水冲洗,洗水稀释后放入废水系统。
大量泄漏:构筑围堤或挖坑收容。用泡沫覆盖,降低蒸气灾害。喷雾状水冷却和稀释蒸汽。用泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。
防护措施
工程控制:生产过程密闭,加强通风。提供安全淋浴和洗眼设备。
呼吸系统防护:可能接触其蒸气时,必须佩戴自吸过滤式防毒面具(全面罩)或自吸式长管面具。紧急事态抢救或撤离时,建议佩戴空气呼吸器。
眼睛防护:呼吸系统防护中已作防护。
身体防护:穿橡胶耐酸碱服。
手防护:戴橡胶耐酸碱手套。
其他防护:工作现场禁止吸烟、进食和饮水。工作完毕,淋浴更衣。注意个人清洁卫生。
消防措施
危险特性:可燃;其蒸气与空气可形成爆炸性混合物,遇明火、高热能引起燃烧爆炸。与强氧化剂接触可发生化学反应。具有较强的腐蚀性。
有害燃烧产物:一氧化碳
灭火剂:抗溶性泡沫、干粉、二氧化碳。
灭火注意事项:消防人员须穿全身防护服、佩戴氧气呼吸器灭火。用水保持火场容器冷却,并用水喷淋保护去堵漏的人员。
环境影响
生态毒性:LC50:175 mg/L(24 h)(蓝鳃太阳鱼);46 mg/L(96 h)(金鱼);122 mg/L(48 h)(金色圆腹雅罗鱼,静态);34 mg/L(48 h)(水蚤)。
安全说明
S23:不要吸入蒸汽。
S26:万一接触眼睛,立即使用大量清水冲洗并送医诊治。
S45:出现意外或者感到不适,立刻到医生那里寻求帮助(最好带去产品容器标签)。
S36/37/39:穿戴适当的防护服、手套和眼睛/面保护 。
危险类别码
R35:引起严重灼伤。
1、急性毒性
LD50:1100 mg/kg(大鼠经口)
LC50:15000 mg/m3(大鼠吸入,15 min)
2、刺激性
家兔经皮:610 mg,轻度刺激(开放性刺激试验)。
家兔经眼:122 mg,重度刺激。
3、亚急性与慢性毒性
小鼠饮水中含0.01%~0.25%游离甲酸,2~4个月内无任何影响0.5%则影响食欲并使其生长缓慢。小鼠吸入10 g/m3 以上时1~4 d 后死亡。
4、致突变性
储存方法
储存于阴凉、通风的库房。远离火种、热源。库温不超过30℃,相对湿度不超过85%。保持容器密封。应与氧化剂、碱类、活性金属粉末分开存放,切忌混储。配备相应品种和数量的消防器材。储区应备有泄漏应急处理设备和合适的收容材料。
运输方法
铁路运输时应严格按照铁道部《危险货物运输规则》中的危险货物配装表进行配装。起运时包装要完整,装载应稳妥。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与氧化剂、碱类、活性金属粉末、食用化学品等混装、混运。运输时运输车辆应配备相应品种和数量的消防器材及泄漏应急处理设备。运输途中应防曝晒、雨淋,防高温。公路运输时要按规定路线行驶,勿在居民区和人口稠密区停留。