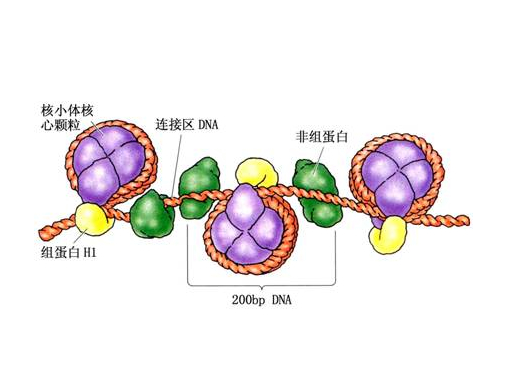
-
非组蛋白 编辑
首先制备一段带有放射性标记的已知特异序列的DNA,将要检测的细胞抽提物与标记DNA混合,进行凝胶电泳。
未结合蛋白的自由DNA在凝胶上迁移最快,而与蛋白质结合的DNA迁移慢,一般结合的蛋白质分子越大,DNA分子的延滞现象越明显,然后通过放射性自显影分析,即可发现一系列DNA带谱,每条带分别代表不同的DNA-蛋白质复合物。每条带相对应的结合蛋白随后再通过细胞抽提物组分分离方法被进一步分开。
2、多样性:非组蛋白占染色质蛋白的60%~70%,不同组织细胞中其种类和数量都不相同,代谢周转快。包括多种参与核酸代谢与修饰的酶类如DNA聚合酶和RNA聚合酶、HMG蛋白(high mobility group protein)、染色体支架蛋白、肌动蛋白和基因表达蛋白等。
3、特异性:能识别特异的DNA序列,识别信息来源于DNA核苷酸序列本身,识别位点存在于DNA双螺旋的大沟部分,识别与结合靠氢键和离子键。在不同的基因组之间,这些非组蛋白所识别的DNA序列在进化上是保守的。这类序列特异性DNA结合蛋白具有一个共同特征,即形成与DNA结合的螺旋区并具有蛋白二聚化的能力。
4、功能多样性:虽然与DNA特异序列结合的蛋白质在每一个真核细胞中只有10 000个分子左右,约占细胞总蛋白的1/50 000,但具有多方面的重要功能,包括基因表达的调控和染色质高级结构的形成。如帮助DNA分子折叠,以形成不同的结构域;协助启动DNA复制,控制基因转录,调节基因表达等。
虽然非组蛋白种类众多,但是根据它们与DNA结合的结构域不同,可分为不同的家族。
α螺旋-转角-α螺旋模式
(helix - turn - helix motif)
这是最早在原核基因的激活蛋白和阻抑物中发现的。迄今已经在百种以上原核细胞和真核生物中发现这种最简单、最普遍的DNA结合蛋白的结构模式。这种蛋白与DNA结合时,形成对称的同型二聚体(symmetric homodimer)结构模式。构成同型二聚体的每个单体由20个氨基酸的小肽组成α螺旋-转角-α螺旋结构,两个α螺旋相互连接构成β转角,其中羧基端的α螺旋为识别螺旋(recognition helix),负责识别DNA大沟的特异碱基信息,另一个α螺旋没有碱基特异性,与DNA磷酸戊糖链骨架接触。这种蛋白在与DNA特异结合时,以二聚体形式发挥作用,结合靠蛋白质的氨基酸侧链与特异碱基对之间形成氢键。锌指模式
(zinc finger motif)
负责 5S RNA、tRNA 和部分 snRNA 基因转录的RNA聚合酶Ⅲ所必须的转录因子。TFⅢ A 是首先被发现的锌指蛋白,由344个氨基酸组成。TFⅢ A 含有9个有规律的锌指重复单位,每个单位30个氨基酸残基,其中一对半胱氨酸和一对组氨酸与Zn2+形成配位键。每个锌指单位是一个DNA结合结构域(DNA-binding domain),每个锌指的 C 末端形成α螺旋负责与DNA结合。这类Cys2/His2锌指单位的共有序列(consensus sequence)是:Cys - X2~4 - Cys - X3 - Leu - X2 - His - X3 - His。哺乳类转录因子 sp1 也有类似的锌指结构,由三个锌指单位组成。另一类锌指蛋白含两对半胱氨酸,而不含组氨酸,如哺乳类细胞的甾体类激素受体蛋白。这类Cys2/Cys2锌指单位的结合Zn2+的共有序列是:Cys - X2- Cys - X13- Cys - X2- Cys。不同的锌指识别不同的碱基序列,因为不同锌指的氨基酸组成不一样。亮氨酸拉链模式
(leucine zipper motif,ZIP)
在构建转录复合物过程中,普遍涉及蛋白与蛋白之间的相互作用,形成二聚体是识别特异DNA序列蛋白的相互作用的共同原则,亮氨酸拉链就是富含Leu残基的一段氨基酸序列所组成的二聚化结构。这类序列特异性DNA结合蛋白家族,包括酵母的转录激活因子(GCN4)、癌蛋白Jun、Fos、Myc以及增强子结合蛋白(enhancer binding protein,C/EBP)等。所有这些蛋白的肽链羧基端约35个氨基酸残基有形成α螺旋的特点,每两圈(7个氨基酸残基)有一个亮氨酸残基。这样,在α螺旋一侧的Leu排成一排,两个蛋白质分子的α - 螺旋之间靠Leu残基之间的疏水作用力形成一条拉链状结构。这类蛋白与DNA的特异结合都是以二聚体形式起作用的,但与DNA结合的结构域是拉链区相邻的肽链 N 端带正电荷的碱性氨基酸区。螺旋-环-螺旋结构模式
(helix - loop - helix motif,HLH)
HLH这一结构模式广泛存在于动、植物DNA结合蛋白中。HLH由40~50个氨基酸组成两个两性α螺旋,两个α螺旋中间被一个或几个β转角组成的环区所分开。每个α螺旋由15~16个氨基酸残基组成,并含有几个保守的氨基酸残基。具有疏水面和亲水面的两性α螺旋有助于二聚体的形成。α螺旋邻近的肽链 N 端也有带正电荷的碱性氨基酸区与靶DNA大沟结合。具有螺旋-环-螺旋结构的蛋白家族成员之间形成同源或异源二聚体是这类蛋白与DNA结合的必要条件,缺失α螺旋的二聚体不能牢固结合DNA。HMG框结构模式
(HMG-box motif)
在发现一组丰富的高速泳动族蛋白(high mobility group protein)以后,首先命名HMG框结构模式。该结构由3个α螺旋组成 boomerAng-shaped 结构模式,具有弯曲DNA的能力。因此,具有HMG框结构的转录因子又称为“构件因子(architeCTural factor)”,它们通过弯曲DNA、促进与邻近位点相结合的其他转录因子的相互作用而激活转录。SRY是一种HMG蛋白,在人类男性性别分化中具有关键作用,HMG蛋白由Y染色体上一个基因编码,在诱导睾丸分化途径中一些相关基因的转录活性被HMG蛋白所激活。