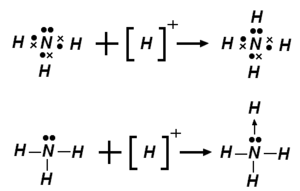-
配位键 编辑
配位键与共价键的本质是否相同
原子之间形成共价键时,若共用电子对只是由一方原子提供电子,而非来自双方原子,这样的共价键就称为配位键,故配位键一定是共价键,也就具有共价键的特征:方向性与饱和性,所以说配位键与共价键没有本质上的差异。
共价键不一定是配位键,关键是看共用电子对的来源是一个成键原子还是两个成键原子提供的,若是由成键的一个原子单方面提供的则为配位键,若是由成键双方原子共同提供的则是普通共价键,所以说配位键与共价键只是在形成过程上有所不同而已。
形成配位键有何条件
配位键是一种特殊的共价键,并不是任意的两个原子相遇就能形成。它要求成键的两个原子中一个原子A有孤对电子,另一个原子B有接受孤对电子的“空轨道”,所以配位键的表示方法为A → B,A称为配体,B称为中心原子或离子。有时为了增强成键能力,中心原子或离子B利用能量相近的空轨道进行杂化后,再来接收以配体原子A的孤电子对。配位键既可以存在于分子中(如H2SO4等),又可以存在于离子之中(如铵根离子、水合氢离子等)。
价键理论
①价键理论。认为配体上的电子进入中心原子的杂化轨道。例如钴(Ⅲ)的配合物。〔CoF6〕3-中F-的孤对电子进入Co3+的sp3d2杂化轨道,这种配合物称为外轨配合物或高自旋配合物,有4个未成对电子,因而是顺磁性的。〔Co(NH3)-6〕3+中NH3的孤对电子进入Co3+的d2sp3杂化轨道 ,这种配合物称为内轨配合物或低自旋配合物,由于所有电子都已成对,因而没有顺磁性而为抗磁性。
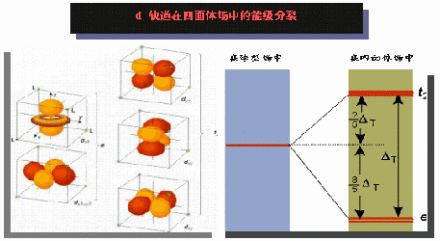
晶体场理论
②晶体场理论。将配体看作点电荷或偶极子,同时考虑配体产生的静电场对中心原子的原子轨道能级的影响。例如,把中心原子引入位于正八面体6个顶角上的6个配体中,原来五重简并的d轨道就分裂成一组二重简并的eg(-y2、dz2)轨道和一组三重简并的t2g(dxy、dxz、dyz)轨道 。eg和t2g轨道的能量差 ,称为分离能Δ0,Δ0≡10Dq,Dq称为场强参量。在上述钴(Ⅲ)配合物中,6个F-产生的场不强,Δ0较小,d电子按照洪特规则排布,有四个未成对电子,因而〔CoF6〕3-为弱场配合物或高自旋配合物 。6个NH3产生的场较强,Δ0较大,d电子按照能量最低原理和泡利不相容原理排布,没有未成对电子 ,因而〔Co(NH3)6〕3+为强场配合物或低自旋配合物。
分子轨道理论
③分子轨道理论 。假定电子是在分子轨道中运动,应用群论或根据成键的基本原则就可得出分子轨道能级图。再把电子从能量最低的分子轨道开始按照泡利原理逐一填入,即得分子的电子组态。分子轨道分为成键轨道和反键轨道。分子的键合程度取决于分子中成键电子数与反键电子数之差。(2) O原子既可以提供一个空的2p轨道,接受外来配位电子对而成键,也可以同时提供二对孤电子对反馈给原配位原子的空轨道而形成反馈键,如在H3PO4中的反馈键称为d-p 键,P≡O键仍只具有双键的性质。
配位化合物是一类比较复杂的分子间化合物,其中含有一个复杂离子,它是一个稳定的结构单元,可以存在于晶体中,也可以存在于溶液中,可以是正离子,也可以是负离子。例如:CuSO4+4NH3 SO4 2++SO42-
3Na++6F-+Al3+=Na3 =3Na++AlF63-
配位共价键简称“配位键”是指两原子的成键电子全部由一个原子提供所形成的共价键,其中,提供所有成键电子的称“配位体(简称配体)”、提供空轨道接纳电子的称“受体”。常见的配体有:氨气(氮原子)、一氧化碳(碳原子)、氰根离子(碳原子)、水(氧原子)、氢氧根(氧原子);受体是多种多样的:有氢离子、以三氟化硼(硼原子)为代表的缺电子化合物、还有大量过渡金属元素。对配位化合物的研究已经发展为一门专门的学科,配位化学。
路易斯酸碱理论的定义是,提供电子对的物质是碱,接受电子对的物质是酸。当路易斯酸与路易斯碱反应时,酸接受碱的电子对,形成配位键 。
“氢氧根”属于配体、而“氢离子”属于受体,这表明,氢离子与氢氧根发生的酸碱中和反应可以看成是氢离子与氢氧根形成配位键的过程。化学家路易斯从这一点出发,提出了“路易斯酸”与“路易斯碱”的概念,认为凡是在配位键成键过程中,能给出电子的,都称为“碱”;能接纳电子的,都称为“酸”。路易斯的酸碱理论把酸和碱的范围扩大了,路易斯酸碱对不仅包括所有的的阿伦尼乌斯酸碱对,还包括一些中性甚至是根本不溶于水的物质。
其实,路易斯酸的本质是配位键中的“受体”;路易斯碱的本质是配位键中的“配体”,二者是等同的。