-
支架蛋白 编辑
中文名:支架蛋白
外文名:scaffoldprotein
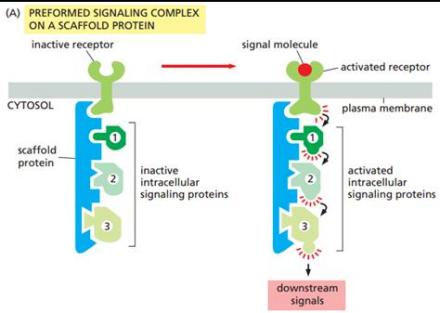 scaffold-based signaling complex
scaffold-based signaling complex
束缚信号组分
这是支架蛋白最基本的功能。支架蛋白将一系列信号组分聚合成复合体。这样的聚合可能能通过组织信号蛋白间的不必要反应来增强信号转导特异性,并通过提高支架蛋白复合物中组分的邻近度及有效浓度增强信号转导效率。支架蛋白增强特异性的一个常见例子是一个支架蛋白同时结合一个蛋白激酶和它的底物,从而保证特异的激酶磷酸化。此外,一些信号蛋白需要多次反应来激活,信号蛋白聚合可能能将这些反应转化为一次造成多种修饰的反应。 因为与信号蛋白的反应可能造成这些信号组分的变构,支架蛋白也可能起到催化作用。这些变构可能能增强或抑制信号蛋白的活性。 例如,有研究提出,促分裂素原活化蛋白激酶(MAPK)通路中的ste5支架蛋白通过fus3促分裂素活化蛋白激酶指示交配信号,方式是通过催化激活fus3的激酶(MAPKK Ste7)来解锁fus3。
信号组分在细胞中的定位
支架蛋白将信号组分定位在细胞的特定区域中,这个过程在信号中间物的局部产生中很重要。一个特别的例子是A型激酶锚定蛋白(AKAP),它将环腺苷酸依赖性蛋白激酶(即蛋白激酶A,PKA)定位在细胞里的不同位置。 这样的定位可以局部调控PKA,使得PKA可以在局部区域磷酸化它的底物。
协助正反馈和负反馈调节
许多关于支架蛋白如何协助正反馈和负反馈调节的假设来自合成支架蛋白及数学建模。在三激酶信号串联中,支架蛋白与所有三个激酶结合,增强激酶特异性,并通过将激酶磷酸化限定于一个下游靶标来限制激酶磷酸化。 这些功能可能与支架蛋白与激酶间的反应、细胞中基础的磷酸酶活动、支架蛋白及信号组分表达水平的稳定性有关。
隔离信号蛋白
反转活性状态及诱导信号组分降解的酶经常使信号通路失去活性。有研究提出支架蛋白保护活化的信号分子免于失活和(或)降解。数学建模显示,没有支架蛋白的串联激酶在它们磷酸化下游靶标之前被磷酸酶去磷酸化的概率更高。更进一步,有研究显示支架蛋白将激酶和与底物及ATP相竞争的抑制剂隔离。
支架蛋白 | 通路 | 蛋白质功能 | 描述 |
KSR | MAPK(促分裂素原活化蛋白激酶) | RAS-ERK通路中的聚合和定位 | 生物学中研究得最详细详细的信号通路之一就是RAS-ERK通路,在这个通路中RAS G蛋白激活MAPKKK RAF,MAPKKK RAF激活MAPKK MEK1,MAPKK MEK1再激活MAPK ERK。已证实有几种支架蛋白参与了这个通路及其它类似的MAPK通路。其中一个支架蛋白是KSR。KSR是这条通路中的一个正性调节因子,它在细胞活动中定位于细胞膜,因此能聚合ERK通路中的组分,并将活化的ERK定位在细胞膜中。 |
AKAP | PKA(蛋白激酶A) | 协助PKA磷酸化下游靶标 | |
AHNAK-1 | 钙信号转导 | 钙通道的聚合和定位 | 钙信号转导在免疫细胞中起到关键作用。近期研究显示,支架蛋白AHNAK1能在细胞膜中准确定位钙通道,从而在T细胞的钙信号转导及活化T细胞核因子(NFAT)的活化中起到重要作用。研究还显示在非免疫细胞中,AHNAK1将PLC-γ和PKC与钙通道结合。与钙结合的蛋白通常终止许多涌入的钙,所以结合这些钙感受器或许在信号由微弱的钙内流引起时格外重要。 |
NLRP | 先天免疫 | 炎性体的聚合 | |
SpiNOphilin(树突棘素) | 树突细胞信号转导 | DC免疫突触蛋白的聚合 | 树突棘素在树突细胞功能中特别地与免疫突触的形成有关。树突细胞与T细胞接触后树突棘素被招募至突触。这样的招募很重要是因为如果没有树突棘素,树突细胞在活体和例题条件下都无法激活T细胞。树突棘素在这个过程中如何促进抗原呈递仍不清楚,但有可能是树突棘素调控突触里细胞接触的持续时间,或者调控细胞中像主要组织相容性复合体(MHC)这样的共刺激分子的循环使用。 |










