-
自由能 编辑
(2)因=1M并不符合实际情况,一般认为=10-7M(pH=7),为了区别其符号写成△G0′;
(3)例如反应,因各种成分并非标准浓度(1M),把实际浓度代入下式后其值△G′就有问题了;
(4)在共轭反应中,要注意各种成分反应的变化量之和;
(5)把△G0改为用平衡常数(Keq)表示,往往是很有用的。
亥姆霍兹自由能
设体系从温度为T环的热源吸取热量δQ,根据第二定律的基本公式dS-δQ/T环≥0;代入第一定律的公式δQ=dU十δW,得:
δW≤-(dU-Tds)
若体系的最初与最后温度和环境的温度相等,即T1=T2=T环,则
δW≤-d(U-Ts)
令
δW≤-DA或W≤-DA
此式的意义是,在等温过程中,一个封闭体系所能做的最大功等于其亥姆霍兹自由能的减少。因此,亥姆霍兹自由能可以理解为等温条件下体系作功的本领。这就是把F叫做功函的原因。若过程是不可逆的,则体系所做的功小于亥姆霍兹自由能的减少(此处等温并不意味着自始至终温度都保持恒定,而是指只要环境温度T环不变,且T1=T2=T环)。还应注意,亥姆霍兹自由能是体系的性质,是状态函数,故DF的值,只决定于体系的始态和终态,而与变化的途径无关(即与可逆与否无关)。但只有在等温的可逆过程中,体系的亥姆霍兹自由能减少(-DF)才等于对外所做的最大功。因此利用可以判断过程的可逆性。
还可以得到一个重要的结论。若体系在等温等容且无其他功的情况下,则-DA≥0,式中等号适用于可逆过程,不等号适用于自发的不可逆过程,即在上述条件下,若对体系任其自然,不去管它,则自发变化总是朝向亥姆霍兹自由能减少的方向进行,直到减至该情况下所允许的最小值,达到平衡为止。体系不可能自动地发生DA>0的变化。
利用亥姆霍兹自由能可以在上述条件下判别自发变化的方向,这就是亥姆霍兹自由能又叫做等温等容位的原因。在等温可逆情况下,-DA=Wmax,,体系亥姆霍兹自由能的减少等于对外所做的最大功。
吉布斯自由能
吉布斯自由能又叫吉布斯函数,是热力学中一个重要的参量,常用G表示 。
它的定义是:G =U−TS + pV =H−TS,
其中U是系统的内能,T是温度(绝对温度,K),S是熵,p是压强,V是体积,H是焓。
吉布斯自由能的微分形式是:dG =−SdT+Vdp+μdN,
其中μ是化学势,也就是说每个粒子的平均吉布斯自由能等于化学势。
如何判断在一个封闭系统内是否发生一个自发过程?吉布斯自由能就是这样一个状态函数之一,而且是最常用的一种:封闭系统在等温等压条件下可能做出的最大有用功对应于状态函数——吉布斯自由能(有时简称自由能或吉布斯函数,符号为G)的变化量。
△G=W′max
有上标加上的“′”的W′通指有用功,下标max则是表示它的绝对值达到最大值。
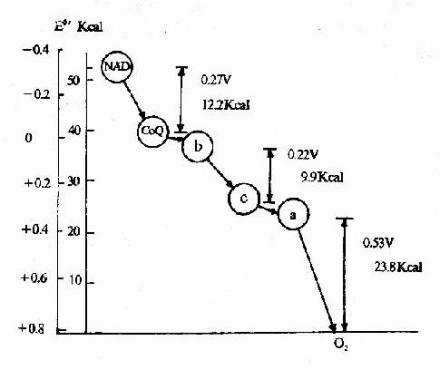
对于化学反应,它的吉布斯自由能的变化量△G可以通过电化学方法测得,即:
△G=-nFE
其中E为原电池的电动势,上式表明,若电动势为E时向外电路释放n mol电子,电池的吉布斯自由能的变化量△G(≡G终态-G始态)就等于-nFE。吉布斯自由能是过程自发性的判断,它的大小相当于系统向环境作最大可能的有用功,因此,我们也可以说,吉布斯自由能是系统做有用功的本领度量,也就是系统过程自发性的度量。不过不要忘记,我们前面已经明确,吉布斯自由能用以度量系统作最大有用功的条件是系统内发生的过程是等温等压过程。若发生等温等容过程或其他过程,需要另作别论。
系统发生自发过程,膨胀功是可正可负的。
总之,在等温等压条件下系统自发过程的判断是:
△G<0,即:△G<0,过程自发;△G>0,过程不自发(逆过程自发);△G=0,达到平衡态。一个自发过程,随着过程的发展,△G的绝对值渐渐减小,过程的自发性渐渐减弱,直到最后,△G=0,达到平衡。
对于一个化学反应,可以像给出它的标准摩尔反应焓△rHmΘ【Θ表示标准状态(273K,101kPa)】一样给出它的标准摩尔反应自由能变化△rGmΘ。
跟热力学能变△U、焓变△H随温度与压力的改变不会发生大的改变完全不同,反应自由能△rGm随温度与压力的改变将发生很大的改变。因此,从热力学数据表中直接查出或计算出来的298.15K,标态下的△rGmΘ(298.15K)的数据,不能用于其它温度与压力条件下,必须进行修正。
用热力学理论可以推导出,求取T温度下的气体压力对△rGmΘ的影响的修正公式为:
J=∏(pi/pΘ)vi
其中∏是算符,表示连乘积(例如,a1×a2×a3=∏ai;i=1,2,3),pΘ为标态压力=100kPa,pi为各种气体(与△rGm(T)对应)的非标态压力,vi是化学方程式中各气态物质的计量系数,故J是以计量系数为幂的非标态下各气体的分压与标准压力之比的连乘积。
若系统中还有溶液,上式应改为:
J=∏(pi/pΘ)vi·∏(ci/cΘ)vi
若系统中只有溶液,则上式又应改为:
J=∏(ci/cΘ)vi
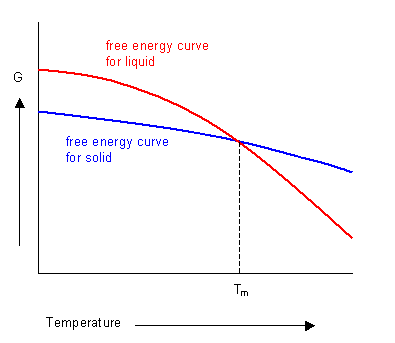
对大多数化学反应而言,温度对反应自由能的影响要大大超过反应物的分压(以及浓度)对反应自由能的影响。通过实验或热力学理论计算,可以得出各种反应的自由能受温度的影响情形。若以反应的标准摩尔自由能△rGmΘ为纵坐标,以反应温度作为横坐标,可以形象地看出温度怎样影响一个反应的标准自由能。
有的反应的自由能随温度升高而增大,有的则减小,曲线的斜率也不尽相同,而且,实验与理论推导都证实,自由能随温度的变化十分接近线性关系,当温度区间不大时,作线性化近似处理不会发生太大偏差,相当于把图中的曲线拉直。借助这种近似处理可以得到温度对反应自由能影响的线性方程:
△rGmΘ=a+bT
a直线在纵坐标上的截距,b是直线的斜率。热力学理论推导了这个方程的截距和斜率,证实截距恰为反应焓△rHmΘ,斜率恰为另一状态函数S的变化值△S的负值(△rSmΘ):
△rGmΘ=△rHmΘ-T△rSmΘ