-
分子伴侣 编辑
中文名:分子伴侣
外文名:molecularchaperones
提出时间:1987年
提出者:Lasky
分子伴侣是细胞中一大类蛋白质,是由不相关的蛋白质组成的一个家系,它们介导其它蛋白质的正确装配,但自己不成为最后功能结构中的组分。分子伴侣的概念有三个特点:
①凡具有这种功能的蛋白,都称为分子伴侣,尽管是完全不同的蛋白质;
②作用机理是不清楚的,故用了“介导”二字,以含糊其辞,“帮助”二字可理解为: 通过催化的或非催化的方式,加速或减缓组装的过程,传递组装所需要的空间信息,也可能抑制组装过程中不正确的副反应。
③ 分子伴侣一定不是最终组装完成的结构的组成部分,但不一定是一个分离的实体。如一些蛋白水解酶的前序列,以及一些核糖核蛋白体的加工前的部分,若具分子伴侣的作用,也称为分子伴侣。组装的涵意比较广,主要指:帮助新生肽的折叠、帮助新生肽成熟为活性蛋白、帮助蛋白质跨膜定位、亚基组装等。
1987 年 Lasky首先提出了分子伴侣(molecular chaperones)的概念。他将细胞核内能与组蛋白结合并能介导核小体有序组装的核质素( nucleoplasmin )称为分子伴侣。根据 Ellis 的定义,这一概念延伸为“一类在序列上没有相关性但有共同功能的蛋白质,它们在细胞内帮助其他含多肽的结构完成正确的组装,而且在组装完毕后与之分离,不构成这些蛋白质结构执行功能时的组份”。热休克蛋白就是一大类分子伴侣。1987年,Ikemura发现枯草杆菌素(subtilisin)的折叠需要前肽(propeptide)的帮助。这类前肽常位于信号肽与成熟多肽之间,在蛋白质合成过程中与其介导的蛋白质多肽链是一前一后合成出来的,并以共价键相连接,是成熟多肽正确折叠所必需的,成熟多肽完成折叠后即通过水解作用与前肽脱离。Shinde和Inouye将这类前肽称为分子内伴侣(intramolecular chaperones)。
参与新生肽链
首先,在蛋白合成过程中,伴侣分子能识别与稳定多肽链的部分折叠的构象,从而参与新生肽链的折叠与装配。例如,植物光合作用的关键酶——二磷酸核酮糖羧化酶加氧酶(Rubisco)在合成时,新合成的亚基单体组装成全酶(共8 个大亚基、8个小亚基,大亚基基因组叶绿体编码,小亚基基因组核编码)之前,就有Rubisco结合蛋白(RBP)参与,实际上就是一种“分子伴侣”。大亚基先与RBP结合,然后与转运进叶绿体的小亚基装配成完整的全酶。抗RBP的抗体阻止新合成的亚基装配成Rubisco。类似的还有大肠杆菌中的“分子伴侣”GroEL,它与GroEs基因构成Gro操纵子,成为热休克蛋白基因调节因子的重要组成部分,参与侵入噬菌体衣壳的组装。线粒体基质中的HSP60(单体分子量60KD,但实际上是十四聚体)参与了 H+-ATP酶F1的β-亚基跨越线粒体膜后与其它亚基间的组装以及鸟氨酸转氨甲酰酶的折叠与组装。内质网膜上的“分子伴侣”免疫球蛋白重链结合蛋白 (Bip)能促进跨膜输入的蛋白质的组装。随着基因工程研究的发展,人们还发现将外源基因导入大肠杆菌进行表达时,其产物虽具有预定一级结构,但并未形成具生物活性的空间结构,这提醒人们有必要了解外源基因在原来生物体内表达时是否有分子伴侣的参与?是哪一类分子伴侣的参与?这些问题的澄清无疑将提高基因工程的效益。
参与蛋白运送
在蛋白跨膜运送过程中,也有分子伴侣的参与。核糖体上新合成的多肽在定向跨膜运送到不同细胞器时,要维持非折叠状态。分子伴侣Hsp70家族在蛋白移位中就能打开前体蛋白的折叠,这时跨膜蛋白疏水基团外露,分子伴侣能够识别并与之结合,保护疏水面,防止相互作用而凝聚,直至跨膜运送开始。跨膜运送后,分子伴侣又参与重折叠与组装过程。
修复热变性蛋白
另外,特别值得一提的是,有一类分子伴侣属于热休克蛋白 (HSP)。这种蛋白是1962年Ritossa在研究果蝇唾腺染色体时首先发现的。果蝇一般在25℃正常生长,当外界温度升至30~40℃时,果蝇体内产生较多的HSP。后来又在酵母、玉米、大豆、大肠杆菌等中发现。当外界温度高出正常生长温度10~15℃,HSP大量诱生。近年来的研究表明在正常生长条件下,这类HSP仍少量存在。以前认为HSP功能是机体为应付不良环境产生对热变性蛋白的修复,进一步研究才知正常生理条件下,HSP对蛋白跨膜运输,结构折叠也有重要作用。上面提及的HSP70、HSP60、GroEL都属于HSP 。
进一步探讨
分子伴侣的作用机理还了解不多,很多问题有待进一步探讨。很有意义的是,每一类分子伴侣在进化上都具有较大的保守性。例如,大肠杆菌中参与噬菌体衣壳组装GroEL与植物叶绿体中Rubisco亚基结合蛋白RBP、线粒体基质中参与鸟氨酸转氨甲酰酶的折叠与组装的HSP60,它们的氨基酸组成上彼此有50%的同源性。抗RBP的抗体甚至与植物、人类、酵母和爪蟾的应激蛋白有交叉反应。
总之,关于分子伴侣的研究才刚刚起步,很多问题还有待深入。又由于分子伴侣对许多蛋白质在细胞内生命活动的发挥至关重要,它必将成为蛋白质化学、分子生物学研究中一个很活跃的领域。
免疫保护
分子伴侣不仅是胞内蛋白折叠、组装与转运的帮助蛋白,更令人惊奇的是它还可以成为感染性疾病中的免疫优势抗原(immunodominant antigens),激发宿主体内的体液免疫反应和T细胞介导的细胞免疫反应,证实在细菌或寄生虫感染中具有免疫保护作用(MinowanDA 1995,Young 1992)。这说明分子伴侣有可能用作疫苗,来抵抗微生物的感染,并用来治疗肿瘤和自身免疫疾病(Suto 1995)。用一个96Ku的肿瘤相关分子伴侣免疫肿瘤病人,已进入一期临床实验(Edgington 1995)。动物疾病模型中的胰岛素依赖型糖尿病、风湿病等可被分子伴侣cpn60抑制,可能是cpn60-反应性T淋巴细胞起了作用。某些情况下,分子伴侣如cpn10中的妊娠早期因子(early pregnancy faCTors,EPF)具有免疫抑制作用,因而具有安胎、防止习惯性流产等治疗价值(Cavanagh 1994)。生理情况下,诱导热休克蛋白Hsp70等的过度表达,能使机体具有更高的缺血耐受能力,减少急性成人呼吸窘迫症造成的器官损害(Currie 1993)。眼球晶状体中的(-晶体蛋白((-crystallin)可以防止其他晶体蛋白的聚集和浊化,因而能够防治白内障(Graw 1997)。随着年龄的增长和受紫外线照射累加效应的影响,可导致(-晶体蛋白的分子伴侣活性减弱,这常常是老年性白内障的病因之一。而有些药物如阿斯匹林、indomethacin等也能介导产生热休克反应。
致病作用
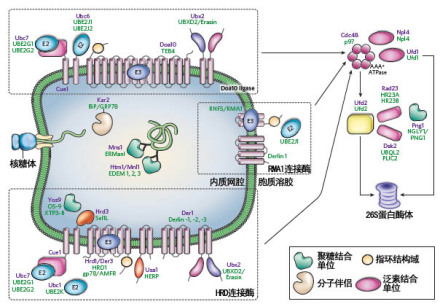
细胞内新生肽链的折叠过程中,其正确折叠需要帮助蛋白如分子伴侣和折叠酶等的参与和介导;而蛋白质的降解还可以由分子伴侣提供的“质控系统(quality control system)”辅助完成(Hammond 1995,)。这种“质控系统”可以识别(recongnizing)、滞留(retaining)和靶向作用(targeting)于错误折叠的蛋白质,促进这些蛋白质聚集或降解,阻碍其正常定位,防止它们干扰细胞的正常功能。
但也可以导致疾病的发生。已知许多编码基因的细微突变如点突变或个别氨基酸的缺失,编码蛋白还具有绝大部分生物活性,只是出现蛋白产物极细微的折叠异常,却可导致疾病的发生。部分原因是“质控系统”在发挥作用:蛋白产物极细微的折叠异常,虽然对活性影响不大,却可以被分子伴侣等识别而滞留在内质网,不能实现正常的转位、转运或分泌,从而不能到达生理位置执行正常的功能,导致疾病发生。
典型的例子有抗胰蛋白酶缺陷病(Teckman 1995)。一种情况是因为抗胰蛋白酶发生Glu???(?Lys的Z突变时,仅有15%的蛋白质分泌出来,其余全部滞留在内质网(ER)。这种滞留的原因部分是由ER的分子伴侣calnexin介导了折叠异常的突变蛋白的聚集。而异常产物的聚集大大妨碍了细胞的正常活动,导致肝硬化(cirrhosis)或肺气肿(emphysema)的发生。另一种疾病是囊性纤维化(cysticfibrosis,CF),囊性纤维性跨膜递质调节蛋白(CFTR)是位于胞膜的cAMP激动型氯离子通道,野生型CFTR有12个跨膜结构域(membrane-spanning domains),大部分位于胞浆。新生CFTR多肽链在ER至少与两个以上的分子伴侣如calnexin和Hsp70形成复合物,脱离分子伴侣的“护送”方可转运至细胞膜(YAng 1993; Pind 1994)。超过70%的CF病人中,CFTR蛋白第508位的苯丙氨酸Phe发生缺失(ΔF508 CFTR),突变体仅有细微的构象变化,但能被“质控系统”识别并将其滞留在内质网,ΔF508 CFTR发生聚集,甚至降解,从而它的转运速度跟不上胞膜氯离子通道蛋白的更新速度,细胞功能受限。实际上,这种只有折叠细微变化的蛋白在特定条件下如低温时,仍可以转运至胞膜,具有绝大部分生理活性(Denning 1992)。可以设想,治疗这种疾病,并不一定非要进行基因治疗不可,而只要完善其转运途径即可。如甘油(glycerol)、二甲基亚砜DMSO(dimethylsulfoxide)和氘化水(deuterated water)等,以及细胞内的氮氧化物三甲亚砜(trimethysulfoxide N-oxide),可以稳定蛋白,增加溶解度,减少CFTR突变蛋白的降解,实现正常运输(Brown 1996)。对应于大分子的分子伴侣,这些小分子的蛋白稳定剂,又称为化学伴侣(chemical chaperones)。
细胞内存在的对抗高渗的渗透剂(osmolytes)就是典型的一类(Welch 1996):碳水化物中除甘油外,还有sorbitol、arabitol、myo-inositol及trehalose;氨基酸及氨基酸衍生物中的甘氨酸等;甲胺类物质中的TMAO,甘油磷酸胆碱(glycero-phosphorylcholine)。当然,并不是所有的蛋白折叠异常导致定位异常。如一些神经系统疾病Alzheimer's病和prion蛋白粒子病,突变蛋白并没有滞留在转运途中,可以到达正常定位位置)。突变蛋白之间的相互作用导致蛋白质发生错误折叠,因为降解不彻底而形成不溶性沉淀。不溶性沉淀形成过多,严重干扰正常的神经活动,引起失能,属于“折叠病(fold diseases)”。prion蛋白粒子病中致病性蛋白(pathogenic prion protein,PrPsc)的聚集,是因为蛋白构象中的一个或多个α螺旋变成了β片层,进入大脑后还能使正常的PrPc(normal PrP)蛋白变成异常的PrPsc蛋白,象介导错误折叠的“模板”,称为“病理性伴侣分子”(pathological chaperones),因而具有感染能力。一些蛋白稳定剂如甘油、DMSO和三甲亚砜等,可以阻止正常蛋白的异常化。Alzheimer's病淀粉样β蛋白N端发生Glu22(Gln的突变时,减少了N端α螺旋的含量,促进了淀粉样变的发生;而引入单个氨基酸突变Val18(Ala,则可以显著增加N端α螺旋的含量,减少了蛋白的淀粉样纤维化。还有其他疾病如遗传性cySTATin C淀粉样变,门冬氨酰葡糖胺缺乏症(Aspartylglycosaminuria),以及一些显性遗传性神经元退变疾病如Huntington’s舞蹈病,脊髓/延髓性肌萎缩(spinal/bulbar muscular atrophy ),I型脊髓小脑性共济失调(spinocerebellar ataxia type I),红色齿状核-苍白球萎缩(dentatorubral-pallidoluysian atrophy),Machado-Joseph疾病(Machado-Joseph desease)均是由于蛋白质突变造成异常折叠,有的形成纤维状聚集物,严重干扰神经系统的正常功能。有的突变蛋白聚集后被降解则引起缺乏症(Ruddon 1996)。有些激素分子如hCG的折叠缺陷还可以引起妇科的恶性肿瘤,有些癌细胞因此缺少正常的细胞外基质(Ruddon 1996)。看来许多遗传性疾病或基因突变疾病实际上是折叠病。
免疫原性
另外,病原体结合的分子伴侣免疫原性很强,在宿主体内能诱发产生某些免疫疾病,如结核,Ieprosy,Legionnaire's病,Iyme病,Q热(Q fever)等(Schoel 1994)。而分子伴侣本身的变化,如cpn10的表达水平下降,可能与全身性致命性线粒体疾病(Agsteribbe 1993)有关。因而,对分子伴侣在各种病理现象中的作用的研究是非常必要的。
伴侣素家族
Cpn 家族是具有独特的双层 7-9 元环状结构的寡聚蛋白,它们以依赖 ATP 的方式促进体内正常和应急条件下的蛋白质折叠。Cpns 又分为两组:GroEL(Hsp60) 家族和TriC 家族。GroEL 型的 Cpns 存在于真细菌、线粒体和叶绿体中,由双层 7 个亚基组成的圆环组成,每个亚基分子量约为 60Ku。它们在体内与一种辅助因子,如E. coli 中的GroES ,协同作用以帮助蛋白折叠。除了叶绿体中的类似物外,这些蛋白是应急反应诱导的。人们对GroEL 和GroES 的结构、功能及其作用机制做了十分详尽的研究。TRiC 型( TCP-1 环状复合物)存在于古细菌和真核细胞质中,由双层 8 或 9 元环组成,亚基分子量约为 55K ,与小鼠中 TCP-1 尾复合蛋白( TCP-1 tail complex protein )有同源性。这种 Cpn 没有类似 GroES 的辅助因子,而且只有古细菌中的成员有应急诱导性;
应激蛋白70 家族
应激蛋白70 家族又称为热休克蛋白70 家族(Hsp70 family ),是一类分子量约70Ku 的高度保守的 ATP 酶,广泛地存在于原核和真核细胞中,包括大肠杆菌胞浆中的 DnaK/ DnaJ ,高等生物内质网中的 Bip 、 Hsc1 、 Hsc 2 、Hsc 4 或Hsc70 ,胞浆中的 Hsp70 、 Hsp68 和 Ssal4p ,线粒体中的Ssclp 、 Hsp70 等。在细胞应急和非应急条件下的蛋白质代谢,如蛋白质的从头折叠(de novo protein folding) 、跨膜运输、错误折叠多肽的降解及其调控过程中有重要的作用。在体内,Hsp70 家族成员的主要功能是以 ATP 依赖的方式结合未折叠多肽链的疏水区以稳定蛋白质的未折叠状态,再通过有控制的释放帮助其折叠。应激蛋白90 家族
即热休克蛋白 90 家 族(Hsp90 family ),分子量在90Ku 左右,包括大肠杆菌胞浆中的HtpG ,酵母胞浆中的Hsp83 与Hsc83 ,果蝇胞浆中的Hsp83 ,以及哺乳类胞浆中的Hsp90 与内质网中的Grp94( Erp90 或内质网素endoplasmin )等。Hsp 90 可以与胞浆中的类固醇激素受体结合,封闭受体的DNA 结合域,阻碍其对基因转录调控区的激活作用,使之保持在天然的非活性状态,但Hsp90 的结合也使受体保持着对激素配体的高亲和力。Hsp90 还与 Ras 信号途径中许多信号分子的折叠与组装密切相关,主要是Hsp90 的结合与解离,介导了这些分子在非活性形式与活性形式间的转化。如转化型酪氨酸激酶pp60v-src 或在一定条件下,从Hsp90 等与之形成的复合物中释放,才能转位至胞膜,行使激酶的活性功能。Casein(CKII) 和 el/f-2a 是两种丝氨酸 / 苏氨酸蛋白激酶,其中Casein(CKII) 与细胞生长和细胞周期有关,el/f-2a 激酶则调节蛋白质合成,两者均可与Hsp90 及其他分子伴侣形成复合物。除 Hsp90 以外,其他分子伴侣如Hsp70,PPIs 等都影响了受体分子的激活过程。其余
此外,其他的分子伴侣还有核质素、T 受体结合蛋白 (TRAP) 、大肠杆菌的SecB 和触发因子(trigger factor )及 PapD 、噬菌体编码的支架蛋白(scaffolding proteins )等。分子伴侣不仅与胞内蛋白的折叠与组装密切相关,影响到蛋白质的转运、定位或分泌;而且与信号转导中的信号分子的活性状态与活性行为相关连,具有重要的生理意义 。