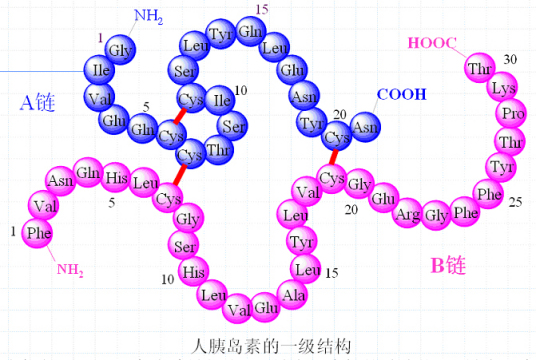
-
二硫键 编辑
中文名:二硫键
外文名:disulfidebond/disulfidebridge/S-Sbond
性质:化学键
反应:2RSH⇌RS−SR’+2H++2e−
释义:连接不同肽链或同一肽链中,两个不同半胱氨酸残基之巯基的化学键
特点:比较稳定
长度:约为2.05A
二硫键结合能力较强,典型的二硫键键离解能为60 kcal/mol (251 kJ/mol)。由于二硫键比C-C键和C-H键弱40%左右,在许多分子中二硫键往往是”弱键”。此外,S-S键反映了二价硫的极化特性,容易被极性试剂(包括亲电试剂和亲核试剂,特别是亲核试剂)切断 。
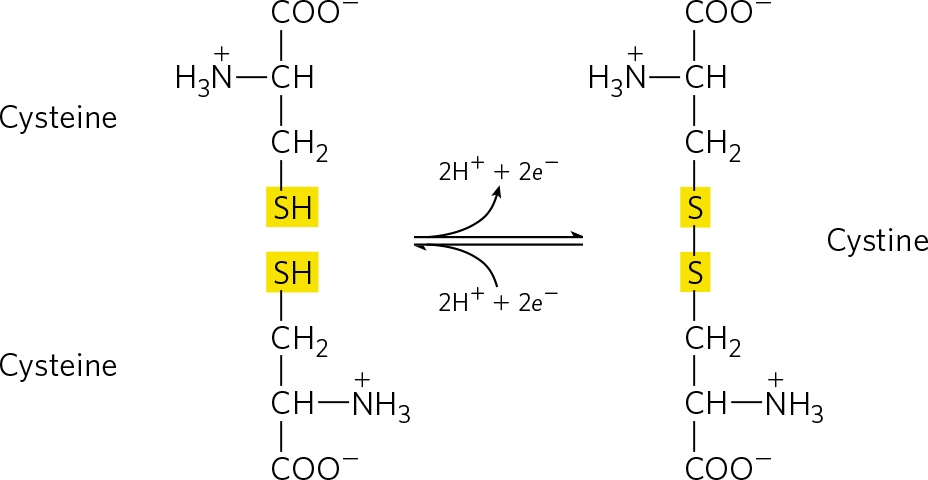 两个半胱氨酸分子的氧化可逆反应,形成二硫键。
两个半胱氨酸分子的氧化可逆反应,形成二硫键。
二硫键的长度约为2.05 A,比C-C键长约0.5 A。绕S-S轴旋转的势垒较低。二硫化物对接近90°的二面角有明显的偏好。当角度接近0°或180°时,二硫化物是一种更好的氧化剂。两个R基团相同的二硫化物称为对称二硫化物的,例如二苯二硫和二甲基二硫。当两个R基团不完全相同时,该化合物被称为不对称或混合二硫化物 。
二硫键与蛋白质高级结构的生物活性有关,同时与蛋白质的复性也有关联。如核糖核酸酶A经巯基乙醇(还原剂)和尿素(蛋白质变性剂)处理后,发生变性作用,4对二硫键断裂,多肽链伸展开来,高级结构发生变化,失去生物活性。如果用透析法将大量还原剂和变性剂除去,在微量还原剂存在下,4对二硫键在原来的位置重新形成,伸展开的多肽肽链会自发折叠成天然构象,生物活性得到恢复。此试验也证明蛋白质高级结构的信息存在于一级结构中 。
二硫键最重要的一个特性就是它在还原剂作用下的裂解。使二硫键裂解的还原剂较多。在生物化学中,常用的还原剂有硫醇如β-巯基乙醇(β-mercaptoethaNOl,β-ME)或二硫苏糖醇(DTT)。通常要使用过量硫醇试剂保证二硫键的完全裂解。其它还原剂还有三羟甲基氨基甲烷磷化氢液,与β-ME和DTT不同,TCEP无味,有选择性的,可以在碱性和酸性环境下工作(不像DTT),更亲水性,耐氧化。此外,在蛋白硫醇修饰前,通常不需要去除TCEP 。
硫醇和二硫键之间的氧化和还原交换是蛋白质中形成和重新排列二硫键的主要反应。蛋白质中二硫键的重排通常通过蛋白质内硫醇和二硫键交换反应进行;半胱氨酸残基的一组硫化物会攻击自身蛋白质的一个二硫键。这种二硫键重排的过程(称为二硫键洗牌)并不会改变蛋白质中二硫键的数量,改变的仅仅是它们的位置。
生物体内通过硫醇和二硫键交换形成的二硫键的氧化和还原变化受到一种硫氧还蛋白的促进。这种小蛋白在所有已知的生物体中都是必需的,它包含两个半胱氨酸氨基酸残基,以邻近的方式排列(一个挨着一个)。这使得它可以形成一个内部二硫键,或者与其他蛋白质形成一个非内部二硫键。因此,它可以作为还原型或氧化型二硫键的存储库。