-
蛋白质 编辑
蛋白质中一定含有碳、氢、氧、氮元素,也可能含有硫、磷等元素。
蛋白质是由α-氨基酸按一定顺序结合形成一条多肽链,再由一条或一条以上的多肽链按照其特定方式结合而成的高分子化合物。蛋白质就是构成人体组织器官的支架和主要物质,在人体生命活动中,起着重要作用,可以说没有蛋白质就没有生命活动的存在。
男性缺失蛋白质比女性缺失蛋白质更需要重视,男士一旦缺失蛋白质,会导致男性精子质量下降,精子活力降低以及精子不液化造成男性不育。
蛋白质是一种复杂的有机化合物,旧称“朊(ruǎn)”。氨基酸是组成蛋白质的基本单位,氨基酸通过脱水缩合连成肽链。蛋白质是由一条或多条多肽链组成的生物大分子,每一条多肽链有二十至数百个氨基酸残基(-R)不等;各种氨基酸残基按一定的顺序排列。蛋白质的氨基酸序列是由对应基因所编码。除了遗传密码所编码的20种基本氨基酸,在蛋白质中,某些氨基酸残基还可以被翻译后修饰而发生化学结构的变化,从而对蛋白质进行激活或调控。多个蛋白质可以一起,往往是通过结合在一起形成稳定的蛋白质复合物,折叠或螺旋构成一定的空间结构,从而发挥某一特定功能。合成多肽的细胞器是细胞质中糙面型内质网上的核糖体。蛋白质的不同在于其氨基酸的种类、数目、排列顺序和肽链空间结构的不同。食入的蛋白质在体内经过消化被水解成氨基酸被吸收后,合成人体所需蛋白质,同时新的蛋白质又在不断代谢与分解,时刻处于动态平衡中。因此,食物蛋白质的质和量、各种氨基酸的比例,关系到人体蛋白质合成的量,尤其是青少年的生长发育、孕产妇的优生优育、老年人的健康长寿,都与膳食中蛋白质的量有着密切的关系。蛋白质又分为完全蛋白质和不完全蛋白质。缺乏必需氨基酸或者含量很少的蛋白质称不完全蛋白质,如谷、麦类、玉米所含的蛋白质和动物皮骨中的明胶等。
 百科x混知:图解蛋白质
百科x混知:图解蛋白质
原子数
由m个氨基酸,n条肽链组成的蛋白质分子,至少含有n个—COOH,至少含有n个—NH2,肽键m-n个,O原子m+n个。
分子质量
设氨基酸的平均相对分子质量为a,含b个二硫键,蛋白质的相对分子质量=ma-18(m-n)-2b
基因控制
基因中的核苷酸 6
信使RNA中的核苷酸 3
蛋白质中氨基酸 1
蛋白质是由C(碳)、H(氢)、O(氧)、N(氮)组成,一般蛋白质可能还会含有P(磷)、S(硫)、Fe(铁)、Zn(锌)、Cu(铜)、B(硼)、Mn(锰)、I(碘)、Mo(钼)等。
这些元素在蛋白质中的组成百分比约为:碳50%、氢7%、氧23%、氮16%、硫0~3%、其他微量。
(1)一切蛋白质都含氮元素,且各种蛋白质的含氮量很接近,平均为16%;
(2)蛋白质系数:任何生物样品中每1g元氮的存在,就表示大约有100/16=6.25G蛋白质的存在, 6.25常称为蛋白质常数。
整体结构
蛋白质是以氨基酸为基本单位构成的生物高分子。蛋白质分子上氨基酸的序列和由此形成的立体结构构成了蛋白质结构的多样性。蛋白质具有一级、二级、三级、四级结构,蛋白质分子的结构决定了它的功能。
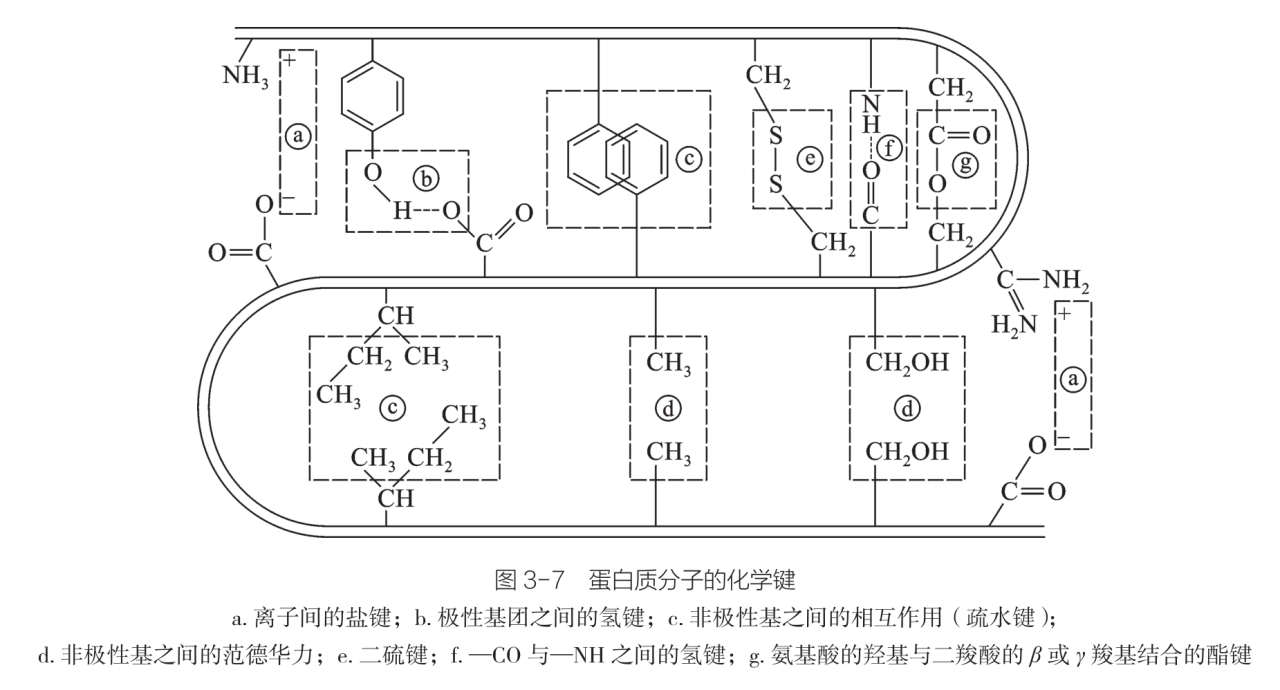 蛋白质分子的化学键
蛋白质分子的化学键
结构级别 | 描述 |
|---|---|
一级结构(Primary struCTure) | 氨基酸残基在蛋白质肽链中的排列顺序称为蛋白质的一级结构,每种蛋白质都有独立而确切的氨基酸序列。肽键是一级结构中连接氨基酸残基的主要化学键,有些蛋白质还包括二硫键。 |
蛋白质分子中肽链并非直链状,而是按一定的规律卷曲(如α-螺旋结构)或折叠(如β-折叠结构)形成特定的空间结构,这是蛋白质的二级结构。蛋白质的二级结构主要依靠肽链中氨基酸残基亚氨基(-NH-)上的氢原子和羰基上的氧原子之间形成的氢键而实现的。二级结构的形式有α-螺旋,β-折叠,β-转角,Ω-环。其中α-螺旋是常见的二级结构,且多为右手螺旋。β-折叠是多肽链形成片层结构,呈锯齿状。β-转角和Ω-环则存在于球状蛋白中。 | |
在二级结构的基础上,肽链还按照一定的空间结构进一步形成更复杂的三级结构。肌红蛋白,血红蛋白等正是通过这种结构使其表面的空穴恰好容纳一个血红素分子。维系球状蛋白质三级结构的作用力有盐键、氢键、疏水作用和范德华力,这些作用力统称为次级键。此外,二硫键在稳定某些蛋白质的空间结构上也起着重要作用。 | |
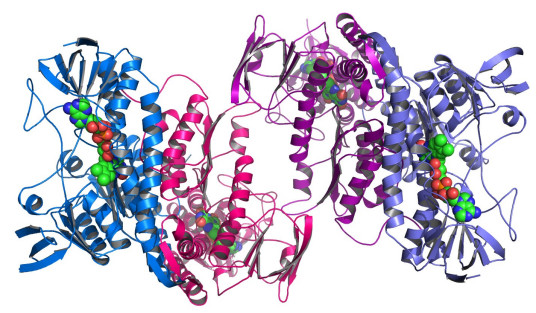
四级结构(Quaternary structure) | 具有三级结构的多肽链按一定空间排列方式结合在一起形成的聚集体结构称为蛋白质的四级结构。如血红蛋白由4个具有三级结构的多肽链构成,其中两个是α-链,另两个是β-链,其四级结构近似椭球形状。 |
连接方法
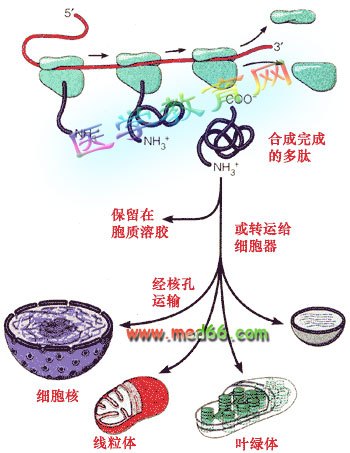
用约20种氨基酸作原料,在细胞质中的核糖体上,将氨基酸分子互相连接成肽链。一个氨基酸分子的氨基和另一个氨基酸分子的羧基,脱去一分子水而连接起来,这种结合方式叫做脱水缩合。通过缩合反应,在羧基和氨基之间形成的连接两个氨基酸分子的那个键叫做肽键。由肽键连接形成的化合物称为肽。
检测方法
分别向甲、乙两支试管加入3毫升蛋清稀释液和清水,再依次向两支试管中加入双缩脲试剂A液和B液。观察甲、乙两试管中溶液发生的颜色变化。上述的演示实验结果表明,双缩脲试剂与蛋白质呈现紫色反应。
2000年,中国营养学会重新修订了推荐的膳食营养素摄入量,新修订的蛋白质推荐摄入量如下:
年龄(岁) | 蛋白质RNI/(g/d) | 年龄(岁) | 蛋白质RNI/(g/d) | ||
男 | 女 | 男 | 女 | ||
0~ | 1.5~3g/(kg·d) | 14~ | 65 | 60 | |
0.5~ | 1.5~3g/(kg·d) | 18~ | |||
1~ | 35 | 35 | |||
2~ | 40 | 40 | 轻体力劳动 | 55 | 45 |
3~ | 45 | 45 | 中体力劳动 | 60 | 50 |
4~ | 50 | 50 | 重体力劳动 | 70 | 60 |
5~ | 55 | 55 | 孕妇 | ||
6~ | 55 | 55 | 早期 | +8 | |
7~ | 60 | 60 | 中期 | +18 | |
8~ | 65 | 65 | 晚期 | +23 | |
9~ | 65 | 65 | 乳母 | +23 | |
10~ | 70 | 65 | 老年 | 75 | 69 |
11~ | 75 | 75 | 按15%蛋白质/总热量计 | ||
● RNI(推荐摄入量):是指可以满足某一特定性别、年龄及生理状况群体中绝大多数个体(97%~98%)的需要量的摄入水平。长期摄入RNI水平,可以满足机体对该营养素的需要,维持组织中适当的营养素储备,保持健康。
蛋白质在胃液消化酶的作用下,初步水解,在小肠中完成整个消化吸收过程。氨基酸的吸收通过小肠黏膜细胞,是由主动运转系统进行,分别转运中性、酸性和碱性氨基酸。在肠内被消化吸收的蛋白质,不仅来自于食物,也有肠黏膜细胞脱落和消化液的分泌等,每天有70g左右蛋白质进入消化系统,其中大部分被消化和重吸收。未被吸收的蛋白质由粪便排出体外。
过量
表现
肾脏要排泄进食的蛋白质,当分解蛋白质时会产生大量的氮素这样会增加肾脏的负担。蛋白质,尤其是动物性蛋白摄入过多,对人体同样有害。首先过多的动物蛋白质的摄入,就必然摄入较多的动物脂肪和胆固醇。其次蛋白质过多本身也会产生有害影响。正常情况下,所以必须将过多的蛋白质脱氨分解,氮则由尿排出体外,这加重了代谢负担,而且,这一过程需要大量水分,从而加重了肾脏的负荷,若肾功能本来不好,则危害就更大。过多的动物蛋白摄入,也造成含硫氨基酸摄入过多,这样可加速骨骼中钙质的丢失,易产生骨质疏松。
危害
1、一旦蛋白质在体内转化为脂肪,血液的酸性就会提高,这样就会消耗大量的钙质,结果储存在骨骼当中的钙质就被消耗了,使骨质变脆。
2、肾脏要排泄进食的蛋白质,当分解蛋白质时会产生大量的氮素这样会增加肾脏的负担。
缺乏症
蛋白质缺乏在成人和儿童中都有发生,但处于生长阶段的儿童更为敏感。蛋白质的缺乏常见症状是代谢率下降,对疾病抵抗力减退,易患病,远期效果是器官的损害,常见的是儿童的生长发育迟缓、营养不良、体质量下降、淡漠、易激怒、贫血以及干瘦病或水肿,并因为易感染而继发疾病。蛋白质的缺乏,往往又与能量的缺乏共同存在即蛋白质—热能营养不良,分为两种,一种指热能摄入基本满足而蛋白质严重不足的营养性疾病,称加西卡病。另一种即为“消瘦”,指蛋白质和热能摄入均严重不足的营养性疾病。
两性
蛋白质是由α-氨基酸通过肽键构成的高分子化合物,在蛋白质分子中存在着氨基和羧基,因此跟氨基酸相似,蛋白质也是两性物质。
水解反应
蛋白质在酸、碱或酶的作用下发生水解反应,经过多肽,最后得到多种α-氨基酸。
蛋白质水解时,应找准结构中键的“断裂点”,水解时肽键部分或全部断裂。
胶体性质
有些蛋白质能够溶解在水里(例如鸡蛋白能溶解在水里)形成溶液。
蛋白质的分子直径达到了胶体微粒的大小(10-9~10-7m)时,所以蛋白质具有胶体的性质。
沉淀
原因:加入高浓度的中性盐、加入有机溶剂、加入重金属、加入生物碱或酸类、少量的盐(如硫酸铵、硫酸钠等)能促进蛋白质的溶解。如果向蛋白质水溶液中加入浓的无机盐溶液,可使蛋白质的溶解度降低,而从溶液中析出,这种作用叫做盐析。
这样盐析出的蛋白质仍旧可以溶解在水中,而不影响原来蛋白质的性质,因此盐析是个可逆过程。利用这个性质,采用分段盐析方法可以分离提纯蛋白质。
变性
在热、酸、碱、重金属盐、紫外线等作用下,蛋白质会发生性质上的改变而凝结起来。这种凝结是不可逆的,不能再使它们恢复成原来的蛋白质。蛋白质的这种变化叫做变性,蛋白质变性之后,紫外吸收,化学活性以及粘度都会上升,变得容易水解,但溶解度会下降。
蛋白质变性后,就失去了原有的可溶性,也就失去了它们生理上的作用。因此蛋白质的变性凝固是个不可逆过程。
造成蛋白质变性的原因
因素类型 | 因素名称 |
|---|---|
物理因素 | |
化学因素 |
颜色反应
蛋白质是由不同氨基酸残基组成的,这些氨基酸残基所含的基团也会发生一些颜色反应。
颜色反应 | 描述 |
|---|---|
茚三酮反应 | 将蛋白质溶液与茚三酮稀溶液混合后加热,溶液呈蓝色。所有蛋白质都能与茚三酮发生显色反应。 |
缩二脲反应 | 将蛋白质溶液与强碱溶液和硫酸铜稀溶液混合后,铜离子与相邻两个肽键上的氮原子和氧原子形成螯合离子而呈现紫红色,此反应称为蛋白质的缩二脲反应。二肽以上的肽和蛋白质都能发生缩二脲反应 |
蛋白黄反应 | 含有苯丙氨酸、酪氨酸和色氢酸残基的蛋白质与浓硝酸作用后呈现黄色,称为蛋白黄反应。这是因为这些氨基酸残基中的苯环与浓硝酸发生硝化反应,生成了黄色的硝基化合物,皮肤 、指甲遇浓硝酸变黄就是基于这个原因。 |
米勒反应 | 含有酪氨酸残基的蛋白质遇硝酸汞的硝酸溶液呈现红色,称为米勒反应。这是由于酪氨酸残基中的酚羟基与汞离子形成了红色化合物,由于大多数蛋白质中都含有酪氨酸残基,因此米勒反应具有普遍性。 |
气味反应
蛋白质在灼烧分解时,可以产生一种烧焦羽毛的特殊气味。利用这一性质可以鉴别蛋白质。
折叠
对蛋白质折叠机理的研究,对保留蛋白质活性,维持蛋白质稳定性和包涵体蛋白质折叠复性都具有重要的意义。早在上世纪30年代,我国生化界先驱吴宪教授就对蛋白质的变性作用进行了阐释,30年后,Anfinsen通过对核糖核酸酶A的经典研究表明,去折叠的蛋白质在体外可以自发的进行再折叠,仅仅是序列本身已经包括了蛋白质正确折叠的所有信息,并提出蛋白质折叠的热力学假说,为此Anfinsen获得1972年诺贝尔化学奖。这一理论有两个关键点:(1)蛋白质的状态处于去折叠和天然构象的平衡中;(2) 天然构象的蛋白质处于热力学最低的能量状态。尽管蛋白质的氨基酸序列在蛋白质的正确折叠中起着核心的作用,各种各样的因素,包括信号序列,辅助因子,分子伴侣,环境条件,均会影响蛋白质的折叠,新生蛋白质折叠并组装成有功能的蛋白质,并非都是自发的,在多数情况下是需要其它蛋白质的帮助,已经鉴定了许多参与蛋白质折叠的折叠酶和分子伴侣,蛋白质“自发折叠”的经典概念发生了转变和更新,但这并不与折叠的热力学假说相矛盾,而是在动力学上完善了热力学观点。在蛋白质的折叠过程中,有许多作用力参与,包括一些构象的空间阻碍,范德华力,氢键的相互作用,疏水效应,离子相互作用,多肽和周围溶剂相互作用产生的熵驱动的折叠,但对于蛋白质获得天然结构这一复杂过程的特异性,我们还知之甚少,许多实验和理论的工作都在加深我们对折叠的认识,但是问题仍然没有解决。
在折叠的机制研究上早期的理论认为,折叠是从变性状态通过中间状态到天然状态的一个逐步的过程,并对折叠中间体进行了深入研究,认为折叠是在热力学驱动下按单一的途径进行的。后来的研究表明折叠过程存在实验可测的多种中间体,折叠通过有限的路径进行。新的理论强调在折叠的初始阶段存在多样性,蛋白质通过许多的途径进入折叠漏斗,从而折叠在整体上被描述成一个漏斗样的图像,折叠的动力学过程被认为是部分折叠的蛋白质整体上的进行性装配,并且伴随有自由能和熵的变化,蛋白质最终寻找到自己的正确的折叠结构,这一理论称为能量图景,漏斗下方的凹凸反映蛋白质构象瞬间进入局部自由能最小区域。
能量图景的示意图,高度代表能量尺度,宽度代表构象尺度,在漏斗(funnel)的下方存在别的低能量状态,共存的不同能量状态的蛋白质种类也降到最小。
这一理论认为结构同源的蛋白质可以通过不同的折叠途径形成相似的天然构象,人酸性成纤维生长因子(hFGF-1)和蝾螈酸性成纤维生长因子(nFGF-1)氨基酸序列具有约80%同源性,并且具有结构同源性(12个β-折叠反向平行排列形成β折叠桶),在盐酸胍诱导去折叠的过程中,hFGF-1可以监测到具有熔球体样的折叠中间体,而nFGF-1经由两态(天然状态到变性状态)去折叠,没有检测到中间体的存在,折叠的动力学研究也表明两种蛋白采用不同的折叠机制。对于同一蛋白质,采用的渗透压调节剂不同,蛋白质折叠的途径也不相同,说明不同的渗透压调节剂对蛋白质的稳定效应不同。这两个例子都说明折叠机制的复杂性,也与上面所介绍的理论相吻合。
构造人的身体
蛋白质是荷兰科学家格利特·马尔德在1838年发现的。他观察到有生命的东西离开了蛋白质就不能生存。蛋白质是生物体内一种极重要的高分子有机物,占人体干重的54%。蛋白质主要由氨基酸组成,因氨基酸的组合排列不同而组成各种类型的蛋白质。人体中估计有10万种以上的蛋白质。生命是物质运动的高级形式,这种运动方式是通过蛋白质来实现的,所以蛋白质有极其重要的生物学意义。人体的生长、发育、运动、遗传、繁殖等一切生命活动都离不开蛋白质。生命运动需要蛋白质,也离不开蛋白质。人体内的一些生理活性物质如胺类、神经递质、多肽类激素、抗体、酶、核蛋白以及细胞膜上、血液中起“载体”作用的蛋白都离不开蛋白质,它对调节生理功能,维持新陈代谢起着极其重要的作用。人体运动系统中肌肉的成分以及肌肉在收缩、作功、完成动作过程中的代谢无不与蛋白质有关,离开了蛋白质,体育锻炼就无从谈起。在生物学中,蛋白质被解释为是由氨基酸借肽键联接起来形成的多肽,然后由多肽连接起来形成的物质。通俗易懂些说,它就是构成人体组织器官的支架和主要物质。蛋白质缺乏:成年人:肌肉消瘦、肌体免疫力下降、贫血,严重者将产生水肿。未成年人:生长发育停滞、贫血、智力发育差,视觉差。蛋白质过量:蛋白质在体内不能贮存,多了肌体无法吸收,过量摄入蛋白质,将会因代谢障碍产生蛋白质中毒甚至于死亡。
2021年10月30日,中国农业科学院饲料研究所发布,我国在国际上首次实现从一氧化碳到蛋白质的合成,已经形成万吨级的工业生产能力,获得首个饲料和饲料添加剂新产品证书。该证书由农业农村部于2021年8月颁发,新饲证字(2021)01号。
2022年7月,谷歌旗下人工智能公司DeepMind进一步破解了几乎所有已知的蛋白质结构,其AlphaFold算法构建的数据库中如今包含了超过2亿种已知蛋白质结构,为开发新药物或新技术来应对饥荒或污染等全球性挑战铺平了道路。
需求情况分类
食物中的蛋白质必须经过肠胃道消化,分解成氨基酸才能被人体吸收利用,人体对蛋白质的需要实际就是对氨基酸的需要。吸收后的氨基酸只有在数量和种类上都能满足人体需要身体才能利用它们合成自身的蛋白质。营养学上将氨基酸分为必需氨基酸和非必需氨基酸两类。
必需氨基酸指的是人体自身不能合成或合成速度不能满足人体需要,必须从食物中摄取的氨基酸。对成人来说,这类氨基酸有8种,包括赖氨酸、蛋氨酸、亮氨酸、异亮氨酸、苏氨酸、缬氨酸、色氨酸、苯丙氨酸。对婴儿来说,有9种,多一种组氨酸。
非必需氨基酸并不是说人体不需要这些氨基酸,而是说人体可以自身合成或由其它氨基酸转化而得到,不一定非从食物直接摄取不可。这类氨基酸包括甘氨酸、丙氨酸、丝氨酸、天冬氨酸、谷氨酸(及其胺)、脯氨酸、精氨酸、组氨酸、酪氨酸、胱氨酸。有些非必需氨基酸如胱氨酸和酪氨酸如果供给充裕还可以节省必需氨基酸中蛋氨酸和苯丙氨酸的需要量。
食物蛋白质的营养价值取决于所含氨基酸的种类和数量,所以在营养上尚可根据食物蛋白质的氨基酸组成,分为完全蛋白质、半完全蛋白质和不完全蛋白质三类。
1.完全蛋白质所含必需氨基酸种类齐全、数量充足、比例适当,不但能维持成人的健康,并能促进儿童生长发育,如乳类中的酪蛋白、乳白蛋白,蛋类中的卵白蛋白、卵磷蛋白,肉类中的白蛋白、肌蛋白,大豆中的大豆蛋白,小麦中的麦谷蛋白,玉米中的谷蛋白等。
2.半完全蛋白质所含必需氨基酸种类齐全,但有的氨基酸数量不足,比例不适当,可以维持生命,但不能促进生长发育,如小麦中的麦胶蛋白等。
3.不完全蛋白质所含必需氨基酸种类不全,既不能维持生命,也不能促进生长发育,如玉米中的玉米胶蛋白,动物结缔组织和肉皮中的胶质蛋白,豌豆中的豆球蛋白等。
外形分类
根据蛋白质分子的外形,可以将其分作3类:
1.球状蛋白质分子形状接近球形,水溶性较好,种类很多,可行使多种多样的生物学功能。
2.纤维状蛋白质分子外形呈棒状或纤维状,大多数不溶于水,是生物体重要的结构成分,或对生物体起保护作用。
3.膜蛋白质一般折叠成近球形,插入生物膜,也有一些通过非共价键或共价键结合在生物膜的表面。生物膜的多数功能是通过膜蛋白实现的。
结构种类
纤维蛋白(fibrous protein):一类主要的不溶于水的蛋白质,通常都含有呈现相同二级结构的多肽链许多纤维蛋白结合紧密,并为单个细胞或整个生物体提供机械强度,起着保护或结构上的作用。
球蛋白(globular protein):紧凑的,近似球形的,含有折叠紧密的多肽链的一类蛋白质,许多都溶于水。典形的球蛋白含有能特异的识别其它化合物的凹陷或裂隙部位。
角蛋白(keratin):由处于α-螺旋或β-折叠构象的平行的多肽链组成不溶于水的起着保护或结构作用蛋白质。
胶原(蛋白)(collagen):是动物结缔组织最丰富的一种蛋白质,它是由原胶原蛋白分子组成。原胶原蛋白是一种具有右手超螺旋结构的蛋白。每个原胶原分子都是由3条特殊的左手螺旋(螺距0.95nm,每一圈含有3.3个残基)的多肽链右手旋转形成的。
伴娘蛋白(chaperone):与一种新合成的多肽链形成复合物并协助它正确折叠成具有生物功能构向的蛋白质。伴娘蛋白可以防止不正确折叠中间体的形成和没有组装的蛋白亚基的不正确聚集,协助多肽链跨膜转运以及大的多亚基蛋白质的组装和解体。
肌红蛋白(myoglobin):是由一条肽链和一个血红素辅基组成的结合蛋白,是肌肉内储存氧的蛋白质,它的氧饱和曲线为双曲线型。
血红蛋白(hemoglobin):是由含有血红素辅基的4个亚基组成的结合蛋白。血红蛋白负责将氧由肺运输到外周组织,它的氧饱和曲线为S型。
蛋白质按其组分进行分类,可分为单纯蛋白质和缀合蛋白质。有些蛋白质分子仅由氨基酸残基组成,不含其他化学成分,这些蛋白质称为单纯蛋白质。而有些蛋白质分子是有氨基酸残基和其他化学成分组成的,这种类型的蛋白质称为缀合蛋白质。
蛋白质按功能进行分类,可分为活性蛋白质和非活性蛋白质。活性蛋白质是指在生命过程中一切有活性的蛋白质,如酶、激素蛋白质等。非活性蛋白质是指对生物体起保护作用或支持作用的蛋白质,如胶原蛋白、角蛋白等。
蛋白质按溶解度进行分类,可分为白蛋白,球蛋白,谷蛋白,醇溶谷蛋白、硬蛋白、组蛋白、精蛋白等。
蛋白质变性(denaturation):生物大分子的天然构象遭到破坏导致其生物活性丧失的现象。蛋白质在受到光照,热,有机溶剂以及一些变性剂的作用时,次级键受到破坏,导致天然构象的破坏,使蛋白质的生物活性丧失。
复性(renaturation):在一定的条件下,变性的生物大分子恢复成具有生物活性的天然构象的现象。
别构效应(allosteric effECT):又称为变构效应,是寡聚蛋白与配基结合改变蛋白质的构象,导致蛋白质生物活性改变的现象。
帮助癌细胞的蛋白质的结构
当癌细胞快速增生时,它们好像需要一种名为survivin的蛋白质的帮助。据一些研究人员报道,survivin蛋白出人意料地以成双配对的形式结合在一起——这一发现很有可能为抗癌药物的设计提供了新的锲机。
为了搞清survivin蛋白到底起什么作用,美国加利福尼亚州的结构生物学家Joseph Noel和同事们率先认真观察了它的三维结构。他们将X射线照射在该蛋白质的晶体上,并测量了X射线的偏转角度,这可以让研究人员计算出蛋白质中每个原子所处的位置。他们得到的结果指出,survivin蛋白形成一种结和,这是其它凋亡抑制物不形成的。这几位研究人员在7月份出版的《自然结构生物学》杂志中报告,survivin分子的一部分出人意料地与另一个survivin分子的相应部分连结在一起,形成了一个被称为二聚物(dimer)的蛋白质对。研究人员推测这些survivin蛋白的二聚物可能在细胞分裂时维持关键的分子结构。如果这种蛋白质必须成双配对后才能发挥作用,那么用一种小分子把它们分开也许能对付癌症。
生物化学家Guy Salvesen说,掌握了survivin蛋白的结构“并没有澄清它是怎样防止细胞自杀的疑点”。但是他说,这些蛋白质配对的事实确实让人惊奇,“你几乎很难找到不重要的二聚作用区域”。他也同意两个蛋白质的接触面将是抗癌症药物集中对付的良好靶标。
来源
蛋白质的主要来源是肉、蛋、奶、和豆类食品,一般而言,来自于动物的蛋白质有较高的品质,含有充足的必需氨基酸。必需氨基酸约有8种,无法由人体自行合成,必须由食物中摄取,若是体内有一种必需氨基酸存量不足,就无法合成充分的蛋白质供给身体各组织使用,其他过剩的蛋白质也会被身体代谢而浪费掉,所以确保足够的必需氨基酸摄取是很重要的。植物性蛋白质通常会有1-2种必需氨基酸含量不足,所以素食者需要摄取多样化的食物,从各种组合中获得足够的必需氨基酸。一块像扑克牌大小的煮熟的肉约含有30-35公克的蛋白质,一大杯牛奶约有8-10公克,半杯的各式豆类约含有6-8公克。所以一天吃一块像扑克牌大小的肉,喝两大杯牛奶,一些豆子,加上少量来自于蔬菜水果和饭,就可得到大约60-70公克的蛋白质,足够一个体重60公斤的长跑选手所需。若是你的需求量比较大,可以多喝一杯牛奶,或是酌量多吃些肉类,就可获得充分的蛋白质。
蛋白质食物是人体重要的营养物质,保证优质蛋白质的补给是关系到身体健康的重要问题,选用既经济又能保证营养的蛋白质是大家普遍关心的话题。
首先,要保证有足够数量和质量的蛋白质食物。根据营养学家研究,一个成年人每天通过新陈代谢大约要更新300g以上蛋白质,其中3/4来源于机体代谢中产生的氨基酸,这些氨基酸的再利用大大减少了需补给蛋白质的数量。一般地讲,一个成年人每天摄入60g~80g蛋白质,基本上已能满足需要。
其次,各种食物合理搭配是一种既经济实惠,又能有效提高蛋白质营养价值的方法。每天食用的蛋白质最好有三分之一来自动物蛋白质,三分之二来源于植物蛋白质。我国人民有食用混合食品的习惯,把几种营养价值较低的蛋白质混合食用,其中的氨基酸相互补充,可以显著提高营养价值。例如,谷类蛋白质含赖氨酸较少,而含蛋氨酸较多。豆类蛋白质含赖氨酸较多,而含蛋氨酸较少。这两类蛋白质混合食用时,必需氨基酸相互补充,接近人体需要,营养价值大为提高。
第三,每餐食物都要有一定质和量的蛋白质。人体没有为蛋白质设立储存仓库,如果一次食用过量的蛋白质,势必造成浪费。相反如食物中蛋白质不足时,青少年发育不良,成年人会感到乏力,体重下降,抗病力减弱。
第四,食用蛋白质要以足够的热量供应为前提。如果热量供应不足,肌体将消耗食物中的蛋白质来作能源。每克蛋白质在体内氧化时提供的热量是18kJ,与葡萄糖相当。用蛋白质作能源是一种浪费,是大材小用。
摄入的蛋白质有可能会过量,保持健康所需的蛋白质含量因人而异。
普通健康成年男性或女性每公斤(2.2 磅)体重大约需要0.8 克蛋白质。
据国外媒体报道,一项开创性研究可能成为老年人长寿和保持健康的关键。美国研究人员发现一种名为SIRT1的蛋白质。它不仅可以延长老鼠寿命,还能推迟和健康有关的发病年龄。另外,它还改善老鼠的总体健康,降低胆固醇水平,甚至预防糖尿病。研究人员表示,虽然这项研究是在老鼠身上进行的,但它有朝一日最终会应用到人类身上。
由美国国家卫生研究院国家衰老研究所的拉斐尔-德卡布博士率领的科研组检测了激活SIRT1的小分子SIRT1720对老鼠健康和寿命产生的影响。德卡布表示:“我们首次验证了人造SIRT1活化剂不仅延长以标准食物为食的老鼠的寿命,还改善它们的健康跨度。这说明我们可能研发出减轻和年龄有关的新陈代谢疾病以及慢性疾负担的分子。”这些研究人员还发现,SRT1720使老鼠的平均寿命延长8.8%。
SRT1720补充剂还降低体重和体脂百分比,改善老鼠一生的肌肉功能和运动协调能力。
科学家发现,SRT1720补充剂降低总胆固醇和有助于抵抗心脏病的低密度脂蛋白胆固醇的水平,改善可能帮助预防糖尿病的胰岛素敏感性。
SIRT1和它的姊妹蛋白质SIRT2在大量物种的新陈代谢中扮演着重要角色为科学家所知。它们还和DNA修复以及基因调节有关,可能帮助预防糖尿病、心脏病和癌症。老鼠在6个月大和其他生命阶段被提供这种补充剂和标准饮食。但专家警告,这项研究还处在一个非常早期的阶段,还没有对人进行相关试验。
1982 美国人S. B. Prusiner发现蛋白质因子Prion,更新了医学感染的概念,于1997年获诺贝尔生理医学奖。
20世纪最惊人的发现之一就是许多蛋白质的活性状态和失活状态可以互相转化,在一个精确控制的溶液条件下(例如通过透析除去导致失活的化学物质),失活的蛋白质可以转变为活性形式。如何使蛋白质恢复到它们的活性状态使生物化学的一个主要研究领域,称为蛋白质折叠学。
蛋白质的合成是通过细胞中的酶的作用将DNA中所隐藏的信息转录到mRNA中,再由tRNA按密码子-反密码子配对的原则,将相应氨基酸运到核糖体中,按照mRNA的编码按顺序排列成串,形成多肽链,再进行折叠和扭曲成蛋白质。蛋白质为生命的基础大分子。可视为生命体的砖块。
通过基因工程,研究者可以改变序列并由此改变蛋白质的结构,靶物质,调控敏感性和其他属性。不同蛋白质的基因序列可以拼接到一起,产生两种蛋白属性的“荒诞”的蛋白质,这种熔补形式成为细胞生物学家改变或探测细胞功能的一个主要工具。另外,蛋白质研究领域的另一个尝试是创造一种具有全新属性或功能的蛋白质,这个领域被称为蛋白质工程。
简史1820年H.布拉孔诺发现甘氨酸和亮氨酸,这是最初被鉴定为蛋白质成分的氨基酸,以后又陆续发现了其他的氨基酸。到19世纪末已经搞清蛋白质主要是由一类相当简单的有机分子——氨基酸所组成。1902年E.菲舍尔和F.霍夫迈斯特各自独立地阐明了在蛋白质分子中将氨基酸连接在一起的化学键是肽键;1907年E.菲舍尔又成功地用化学方法连接了18个氨基酸首次合成了多肽,从而建立了作为蛋白质化学结构基础的多肽理论。对蛋白质精确的三维结构知识主要来自对蛋白质晶体的X射线衍射分析,1960 年J.C.肯德鲁首次应用X射线衍射分析技术测定了肌红蛋白的晶体结构,这是第一个被阐明了三维结构的蛋白质。中国科学工作者在1965年用化学合成法全合成了结晶牛胰岛素,首次实现了蛋白质的人工合成;在1969~1973年期间,先后在2.5埃和1.8埃分辨率水平测定了猪胰岛素的晶体结构,这是中国阐明的第一个蛋白质的三维结构。
活性
蛋白质分子在受到外界的一些物理和化学因素的影响后,分子的肽链虽不裂解,但其天然的立体结构遭致改变和破坏,从而导致蛋白质生物活性的丧失和其他的物理、化学性质的变化,这一现象称为蛋白质的变性。早在1931年中国生物化学家吴宪就首次提出了正确的变性作用理论。引起蛋白质变性的主要因素有:①温度。②酸碱度。③有机溶剂。④脲和盐酸胍。这是应用最广泛的蛋白质变性试剂。⑤去垢剂和芳香环化合物。
蛋白质的变性常伴随有下列现象:①生物活性的丧失。这是蛋白质变性的最主要特征。②化学性质的改变。③物理性质的改变。在变性因素去除以后,变性的蛋白质分子又可重新回复到变性前的天然的构象,这一现象称为蛋白质的复性。蛋白质的复性有完全复性、基本复性或部分复性。只有少数蛋白质在严重变性以后,能够完全复性。蛋白质变性和复性的研究,对了解体内体外的蛋白质分子的折叠过程十分重要。主要通过蛋白质的变性和复性的研究,肯定了蛋白质折叠的自发性,证实了蛋白质分子的特征三维结构仅仅决定于它的氨基酸序列。活性蛋白质分子在生物体内刚合成时,常常不呈现活性,即不具有这一蛋白质的特定的生物功能。要使蛋白质呈现其生物活性,一个非常普遍的现象是,蛋白质分子的肽链在一些生化过程中必须按特定的方式断裂。蛋白质的激活是生物的一种调控方式,这类现象在各种重要的生命活动中广泛存在。
很多蛋白质由亚基组成,这类蛋白质在完成其生物功能时,在效率和反应速度的调节方面,很大程度上依赖于亚基之间的相互关系。亚基参与蛋白质功能的调节是一个相当普遍的现象,特别在调节酶的催化功能方面。有些酶存在和活性部位不重叠的别构部位,别构部位和别构配体相结合后,引起酶分子立体结构的变化,从而导致活性部位立体结构的改变,这种改变可能增进,也可能钝化酶的催化能力。这样的酶称为别构酶。已知的别构酶在结构上都有两个或两个以上的亚基。
功能
蛋白质在生物体中有多种功能。
催化功能:有催化功能的蛋白质称酶,生物体新陈代谢的全部化学反应都是由酶催化来完成的。
运动功能:从最低等的细菌鞭毛运动到高等动物的肌肉收缩都是通过蛋白质实现的。肌肉的松弛与收缩主要是由以肌球蛋白为主要成分的粗丝以及以肌动蛋白为主要成分的细丝相互滑动来完成的。
运输功能:在生命活动过程中,许多小分子及离子的运输是由各种专一的蛋白质来完成的。例如在血液中血浆白蛋白运送小分子、红细胞中的血红蛋白运送氧气和二氧化碳等。
机械支持和保护功能:高等动物的具有机械支持功能的组织如骨、结缔组织以及具有覆盖保护功能的毛发、皮肤、指甲等组织主要是由胶原、角蛋白、弹性蛋白等组成。
免疫和防御功能:生物体为了维持自身的生存,拥有多种类型的防御手段,其中不少是靠蛋白质来执行的 。例如抗体即是一类高度专一的蛋白质,它能识别和结合侵入生物体的外来物质,如异体蛋白质、病毒和细菌等,取消其有害作用。
调节功能:在维持生物体正常的生命活动中,代谢机能的调节,生长发育和分化的控制,生殖机能的调节以及物种的延续等各种过程中,多肽和蛋白质激素起着极为重要的作用。此外,尚有接受和传递调节信息的蛋白质,如各种激素的受体蛋白等。
发展
蛋白质作为生命活动中起重要作用的生物大分子,与一切揭开生命奥秘的重大研究课题都有密切的关系。蛋白质是人类和其他动物的主要食物成分,高蛋白膳食是人民生活水平提高的重要标志之一。许多纯的蛋白质制剂也是有效的药物,例如胰岛素、人丙种球蛋白和一些酶制剂等。在临床检验方面,测定有关酶的活力和某些蛋白质的变化可以作为一些疾病临床诊断的指标,例如乳酸脱氢酶同工酶的鉴定可以用作心肌梗塞的指标,甲胎蛋白的升高可以作为早期肝癌病变的指标等。在工业生产上,某些蛋白质是食品工业及轻工业的重要原料,如羊毛和蚕丝都是蛋白质,皮革是经过处理的胶原蛋白。在制革、制药、缫丝等工业部门应用各种酶制剂后,可以提高生产效率和产品质量。蛋白质在农业、畜牧业、水产养殖业方面的重要性,也是显而易见的。
蛋白质可作为一种试剂用于筛选能够促进或抑制本发明蛋白质活性的化合物或其盐。进而,这种化合物或其盐以及抑制本发明蛋白质活性的中和抗体可用作治疗或预防支气管哮喘、慢性阻塞性肺部疾病等的药物。
蛋白质在细胞和生物体的生命活动过程中,起着十分重要的作用。生物的结构和形状都与蛋白质有关。蛋白质还参与基因表达的调节,以及细胞中氧化还原、电子传递、神经传递乃至学习和记忆等多种生命活动过程。在细胞和生物体内各种生物化学反应中起催化作用的酶主要也是蛋白质。许多重要的激素,如胰岛素和胸腺激素等也都是蛋白质。此外,多种蛋白质,如植物种子(豆、花生、小麦等)中的蛋白质和动物蛋白、奶酪等都是供生物营养生长之用的蛋白质。有些蛋白质如蛇毒、蜂毒等是动物攻防的武器。
蛋白质占人体的20%,占身体比例最大。胆汁,尿液除外,都是蛋白质合成的。只有蛋白质充足,才能代谢正常。就像盖房子,构建身体的原材料最主要的是蛋白质。
1.蛋白质是构建新组织的基础材料,是酶,激素合成的原料;维持钾钠平衡;消除水肿。
2.是合成抗体的成分:白细胞,T淋巴细胞,干扰素等,提高免疫力。
3.提供一部分能量。
4.调低血压,缓冲贫血,是红细胞的载体。
5.形成人体的胶原蛋白。眼球玻璃体,视紫质都有胶原蛋白。
7.大脑细胞分裂的动力源是蛋白质;脑脊液是蛋白质合成的;记忆力下降
8.性功能障碍
9.肝脏:造血功能;合成激素,酶;解毒。缺乏蛋白质,肝细胞不健康。有一副好肝脏,人健康就有保障。
10.心脏---泵器官。缺乏蛋白质会出现手脚冰凉;缺氧;心肌缺氧造成心力衰竭----死亡。
11.脾胃:每天都要消化食物,消化酶是蛋白质合成的。缺乏会造成胃动力不够,消化不良,打嗝。胃溃疡,胃炎;胃酸过多,刺激溃疡面你会感觉到疼,蛋白质唯一具有修复再造细胞的功能。消化壁上有韧带,缺乏蛋白质会松弛,内脏下垂,子宫下垂脏器移位。
12.四肢:人老先老腿,缺乏蛋白质肌肉萎缩;骨头的韧性减低,易骨折
13.抗体会减少,易感冒,发烧。
历史
在18世纪,安东尼奥·弗朗索瓦(Antoine Fourcroy)和其他一些研究者发现蛋白质是一类独特的生物分子,他们发现用酸处理一些分子能够使其凝结或絮凝。当时他们注意到的例子有来自蛋清、血液、血清白蛋白、纤维素和小麦面筋里的蛋白质。荷兰化学家格利特·马尔德(Gerhardus Johannes Mulder)对一般的蛋白质进行元素分析发现几乎所有的蛋白质都有相同的实验公式。用“蛋白质”这一名词来描述这类分子是由Mulder的合作者永斯·贝采利乌斯于1838年提出。Mulder随后鉴定出蛋白质的降解产物,并发现其中含有为氨基酸的亮氨酸,并且得到它(非常接近正确值)的分子量为131Da。
对于早期的生物化学家来说,研究蛋白质的困难在于难以纯化大量的蛋白质以用于研究。因此,早期的研究工作集中于能够容易地纯化的蛋白质,如血液、蛋清、各种毒素中的蛋白质以及消化性和代谢酶(获取自屠宰场)。1950年代后期,Armour Hot Dog Co.公司纯化了一公斤纯的牛胰腺中的核糖核酸酶A,并免费提供给全世界科学家使用。科学家可以从生物公司购买越来越多的各类纯蛋白质。
著名化学家莱纳斯·鲍林成功地预测了基于氢键的规则蛋白质二级结构,而这一构想最早是由威廉·阿斯特伯里于1933年提出。随后,Walter Kauzman在总结自己对变性的研究成果和之前Kaj Linderstrom-LAng的研究工作的基础上,提出了蛋白质折叠是由疏水相互作用所介导的。1949年,弗雷德里克·桑格首次正确地测定了胰岛素的氨基酸序列,并验证了蛋白质是由氨基酸所形成的线性(不具有分叉或其他形式)多聚体。原子分辨率的蛋白质结构首先在1960年代通过X射线晶体学获得解析;到了1980年代,NMR也被应用于蛋白质结构的解析,冷冻电子显微学被广泛用于对于超大分子复合体的结构进行解析。截至到2008年2月,蛋白质数据库中已存有接近50,000个原子分辨率的蛋白质及其相关复合物的三维结构的坐标。
研究方法
蛋白质是被研究得最多的一类生物分子,对它们的研究包括“体内”(in vivo)和“体外”(in vitro)。体外研究多应用于纯化后的蛋白质,将它们置于可控制的环境中,以期获得它们的功能信息;例如,酶动力学相关的研究可以揭示酶催化反应的化学机制和与不同底物分子之间的相对亲和力。而体内研究实验着重于蛋白质在细胞或者整个组织中的活性作用,从而可以了解蛋白质发挥功能的场所和相应的调节机制。
抗癌作用
当癌细胞快速增生时,需要一种名为survivin的蛋白质的帮助。这种蛋白质由凋亡抑制基因Survivin编码合成在癌细胞中含量很丰富,但在正常细胞中却几乎不存在。癌细胞与survivin蛋白的这种依赖性使得survivin自然成为制造新抗癌药物的靶标,但是在怎样对付survivin蛋白这个问题上却仍有一些未解之谜。
Survivin蛋白属于一类防止细胞自我破坏(即凋亡)的蛋白质。这类蛋白质主要通过抑制凋亡酶(caspases)的作用来阻碍其把细胞送上自杀的道路。以前一直没有科学家观察到survivin蛋白与凋亡酶之间的相互作用。也有其它迹象表明survivin蛋白扮演着另一个不同的角色——在细胞分裂后帮助把细胞拉开。
生物化学家GuySalvesen掌握了survivin蛋白的结构“并没有澄清它是怎样防止细胞自杀的疑点”。这些蛋白质配对的事实确实让人惊奇,几乎很难找到不重要的二聚作用区域。两个蛋白质的接触面将是抗癌症药物集中对付的良好靶标。
组学
在1996年前提到蛋白质组学(Proteomics),恐怕知之者甚少,而在略知一二者中,部分人还抱有怀疑态度。但是,2001年的Science杂志已把蛋白质组学列为六大研究热点之一,其“热度”仅次于干细胞研究,名列第二。蛋白质组学的受关注程度如今已令人刮目相看。
1.蛋白质组学研究的研究意义和背景
随着人类基因组计划的实施和推进,生命科学研究已进入了后基因组时代。在这个时代,生命科学的主要研究对象是功能基因组学,包括结构基因组研究和蛋白质组研究等。尽管已有多个物种的基因组被测序,但在这些基因组中通常有一半以上基因的功能是未知的。功能基因组中所采用的策略,如基因芯片、基因表达序列分析(Serial analysis of gene expression,SAGE)等,都是从细胞中mRNA的角度来考虑的,其前提是细胞中mRNA的水平反映了蛋白质表达的水平。但事实并不完全如此,从DNA、mRNA、蛋白质,存在三个层次的调控,即转录水平调控(Transcriptional control ),翻译水平调控(Translational control),翻译后水平调控(Post-translational control )。从mRNA角度考虑,实际上仅包括了转录水平调控,并不能全面代表蛋白质表达水平。实验也证明,组织中mRNA丰度与蛋白质丰度的相关性并不好,尤其对于低丰度蛋白质来说,相关性更差。更重要的是,蛋白质复杂的翻译后修饰、蛋白质的亚细胞定位或迁移、蛋白质-蛋白质相互作用等则几乎无法从mRNA水平来判断。毋庸置疑,蛋白质是生理功能的执行者,是生命现象的直接体现者,对蛋白质结构和功能的研究将直接阐明生命在生理或病理条件下的变化机制。蛋白质本身的存在形式和活动规律,如翻译后修饰、蛋白质间相互作用以及蛋白质构象等问题,仍依赖于直接对蛋白质的研究来解决。虽然蛋白质的可变性和多样性等特殊性质导致了蛋白质研究技术远远比核酸技术要复杂和困难得多,但正是这些特性参与和影响着整个生命过程。
2.蛋白质组学研究的策略和范围
蛋白质组学一经出现,就有两种研究策略。一种可称为“竭泽法”,即采用高通量的蛋白质组研究技术分析生物体内尽可能多乃至接近所有的蛋白质,这种观点从大规模、系统性的角度来看待蛋白质组学,也更符合蛋白质组学的本质。但是,由于蛋白质表达随空间和时间不断变化,要分析生物体内所有的蛋白质是一个难以实现的目标。另一种策略可称为“功能法”,即研究不同时期细胞蛋白质组成的变化,如蛋白质在不同环境下的差异表达,以发现有差异的蛋白质种类为主要目标。这种观点更倾向于把蛋白质组学作为研究生命现象的手段和方法。
早期蛋白质组学的研究范围主要是指蛋白质的表达模式(Expression profile),随着学科的发展,蛋白质组学的研究范围也在不断完善和扩充。蛋白质翻译后修饰研究已成为蛋白质组研究中的重要部分和巨大挑战。蛋白质-蛋白质相互作用的研究也已被纳入蛋白质组学的研究范畴。而蛋白质高级结构的解析即传统的结构生物学,虽也有人试图将其纳入蛋白质组学研究范围,但仍独树一帜。
3.蛋白质组学研究技术
可以说,蛋白质组学的发展既是技术所推动的也是受技术限制的。蛋白质组学研究成功与否,很大程度上取决于其技术方法水平的高低。蛋白质研究技术远比基因技术复杂和困难。不仅氨基酸残基种类远多于核苷酸残基(20/ 4), 而且蛋白质有着复杂的翻译后修饰,如磷酸化和糖基化等,给分离和分析蛋白质带来很多困难。此外,通过表达载体进行蛋白质的体外扩增和纯化也并非易事,从而难以制备大量的蛋白质。蛋白质组学的兴起对技术有了新的需求和挑战。蛋白质组的研究实质上是在细胞水平上对蛋白质进行大规模的平行分离和分析,往往要同时处理成千上万种蛋白质。因此,发展高通量、高灵敏度、高准确性的研究技术平台是相当一段时间内蛋白质组学研究中的主要任务。在国际蛋白质组研究技术平台的技术基础和发展趋势有以下几个方面:
3.2 蛋白质组研究中的样品分离和分析
利用蛋白质的等电点和分子量通过双向凝胶电泳的方法将各种蛋白质区分开来是一种很有效的手段。它在蛋白质组分离技术中起到了关键作用。如何提高双向凝胶电泳的分离容量、灵敏度和分辨率以及对蛋白质差异表达的准确检测是双向凝胶电泳技术发展的关键问题。国外的主要趋势有第一维电泳采用窄pH梯度胶分离以及开发与双向凝胶泳相结合的高灵敏度蛋白质染色技术,如新型的荧光染色技术。
质谱技术是蛋白质组研究中发展最快,也最具活力和潜力的技术。它通过测定蛋白质的质量来判别蛋白质的种类。当前蛋白质组研究的核心技术就是双向凝胶电泳-质谱技术,即通过双向凝胶电泳将蛋白质分离,然后利用质谱对蛋白质逐一进行鉴定。对于蛋白质鉴定而言,高通量、高灵敏度和高精度是三个关键指标。一般的质谱技术难以将三者合一,而发展的质谱技术可以同时达到以上三个要求,从而实现对蛋白质准确和大规模的鉴定。
蛋白质的含氮量比较恒定,平均约为16%。
与身高的关系
据报道,第二次世界大战期间,日本动物性食品供应不足,每人每年只平均供应2千克肉,12.5千克奶和奶制品,2.5千克蛋。当时12岁学生平均身高只有137.8厘米。战后,日本经济发展迅速,人民生活改善,动物性食品增多,每人每年食用肉达13千克,奶及奶制品25千克,蛋类15千克。1970年调查,12岁少年(少年食品)的身高已达147.1厘米,平均增高9.3厘米。从这个例子可以看出蛋白质食物(蛋白质食品)对少年儿童(儿童食品)增高所起的作用。
蛋白质是构成一切生命的主要化合物,是生命的物质基础和第一要素,在营养素中占首要地位。少年儿童及婴幼儿增高离不开蛋白质。人体的骨骼等组织是由蛋白质组成的。在体内新陈代谢的全部化学反应过程中,离不开酶的催化作用,而所有的酶均由蛋白质构成。对青少年增高起作用的各种激素,也都是蛋白质及其衍生物。此外,参与骨细胞分化、骨的形成、骨的再建和更新等过程的骨矿化结合素、骨钙素、碱性磷酸酶、人骨特异生长因子等物质,也均为蛋白质所构成。所以,蛋白质是人体生长发育中最重要的化合物,是增高的重要原料。
婴幼儿(婴幼儿食品)、少年儿童生长发育所必需的脂溶性维生素(维生素食品)、铁(铁食品)、钙、磷等无机盐及部分微量元素(微量元素食品),在蛋白质食物中也同时可以获得。所以,有些儿童少年只喜欢吃素食(素食食品),怕吃鸡、鱼、肉、蛋等荤菜,或是在家长的催督下才勉强吃一点,这种做法是不可取的,必然会导致因蛋白质缺乏而影响身高。
正确的膳食原则是食物要多样,粗细要搭配,坚持以粮、豆、菜为主,适当增加肉、鱼、蛋、奶的量,以补充身体发育的充足营养,保证身高增加的原料,促进个子长高。
蛋白质的蛋白质食物来源可分为植物性蛋白质和动物性蛋白质两大类。植物蛋白质中,谷类含蛋白质10%左右,蛋白质含量不算高,但由于是人们的主食,所以仍然是膳食蛋白质的主要来源。豆类含有丰富的蛋白质,特别是大豆含蛋白质高达36%~40%,氨基酸组成也比较合理,在体内的利用率较高,是植物蛋白质中非常好的蛋白质来源。
蛋类含蛋白质11%~14%,是优质蛋白质的重要来源。奶类(牛奶)一般含蛋白质3.0%~3.5%,是婴幼儿蛋白质的最佳来源。蛋白质由氨基酸构成,在人体必需的22种氨基酸中,有9种氨基酸(氨基酸食品)是人体不能合成或合成量不足的,必须通过饮食才能获得。
肉类包括禽、畜和鱼的肌肉。新鲜肌肉含蛋白质15%~22%,肌肉蛋白质营养价值优于植物蛋白质,是人体蛋白质的重要来源。
蛋白质的主要来源,分为动物性蛋白质、植物性蛋白质。一般来说,动物蛋白质的营养价值比植物蛋白质高。以每500克所含的蛋白质计算,含蛋白质丰富的食品有:
①肉食类:猪肉84.5克,牛肉100.5克,猪肝100.5克;
②蛋类:鸡蛋63.5克,鸭蛋63克;
④米面类:小麦粉60.5克,大麦50克,玉米42.5克;
⑥蔬菜类:黄花菜70克,海带41克。大豆蛋白质的营养较好,与动物蛋白都是优质蛋白质。
计算需要量
蛋白质的需要量,因健康状态、年龄、体重等各种因素也会有所不同。身材越高大或年龄越小的人,需要的蛋白质越多。
以下数字是不同年龄的人所需蛋白质的指数:
年龄/岁 | 1~3 | 4~6 | 7~10 | 11~14 | 15~18 | 19以上 |
|---|---|---|---|---|---|---|
指数 | 1.80 | 1.49 | 1.21 | 0.99 | 0.88 | 0.79 |
其计算方法为:
先找出自己的年龄段指数;再用此指数乘以自己体重(公斤);所得的答案就是您一天所需要的蛋白质克数。
例如:体重50公斤,年龄33岁,其指数是0.79。
0.79×50=39.5克。这就是一天所需要的蛋白质的量。
平均一天之中蛋白质的需要量最少约是45克,也就是一餐大约15克。注意,早餐必须摄取充分的蛋白质。
适用于所有需要补充蛋白质的人群。孕妇和哺乳期妇女、工作压力大的都市白领、经常熬夜工作、年长的父母、生长发育期的少年儿童、手术康复者、高血压。
分娩后补充
对于分娩后蛋白质的摄入要注意三点:
第一,蛋白质的摄入量要足够,因为新妈妈哺乳需要摄入充足的蛋白质;
第二,蛋白质应该是优质的,一般来说,鱼虾类蛋白质比肉类要好,肉类白肉比红肉好。尽量不要吃可能有激素人工喂养动物的肉类,而应吃天然的食品;
第三,蛋白质摄入要均衡,不要只选择一种食物吃。
少数人乳汁量不够,下奶比较慢,为了有助于下奶,可喝一些加有中药成分的汤类。这有助于母亲身体的恢复调理(子宫收缩、恶露排出),下奶通畅,并可补充营养。
健身人群补充
健身锻炼期间,人体对蛋白质的需求比其他阶段要旺盛得多。粮食类蛋白质含有的赖氨酸较少,如果将其与大豆、肉食、蛋类等含有较多赖氨酸的食物搭配食用,就会相互提高几者间的营养价值。再比如,大豆中含有的蛋氨酸很低,而玉米中蛋氨酸却很高,如果两者之间组合一下,就会产生互补,提高营养价值。
通过上面的实例,在健身锻炼期间调整我们以往的饮食结构,实现食物多样化,粗粮细粮均衡搭配,动物蛋白合理分配到每一餐,适量摄取豆制品,可以很好地提高我们每一餐的营养价值。在这一情况下进行健身锻炼,最终表现出来的结果是健身效果明显提高。