-
生物样品 编辑
一般原则
选择一定数量的能符合大多数情况的植株为样品。采集作物或蔬菜时,不要选择田埂边上及离田埂2m范围以内的样品;如采集水生植物,则应注意离开污水排放口适当距离。
2、典型性和适时性
采样的部位要能充分反映所了解的情况,这就是典型性。而适时性是根据研究的目的和环境污染物对植物的影响,必须按照植株的生长状况,发育阶段以及植株的不同部位,如根、茎、叶和果实或具体要求进行分别采样。为了植株同一部分进行比较分析,不能将植株的上、下部位随意混合。
采集方法
1、采样前的准备工作
采样前应预先准备好采集工具,如小铲、枝剪、剪刀、布和塑料袋等,还有标签、记录本、样品采集登记表等物品。
2、样品采集量
样品采集量主要是考虑样品部位处理后的代表性及是否够测定用。为了保证足够的数量,一般要求至少有20~50g干样品,最好有1kg干样。如果是新鲜的样品,以含80%~90%的水分来计算,要比干样量多5~10倍,最好5~10kg。总之应以不少于0.5kg新鲜样品为原则。对水生植物、水果、蔬菜等含水量高的植物,采样量还需酌情增加。
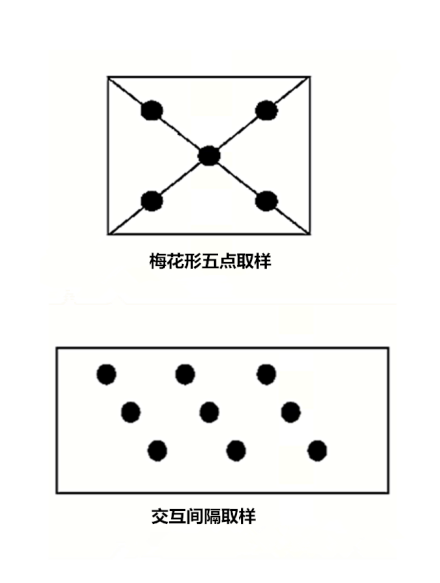
3、样品的采集在已选好的样区做成样方,草木及农作物样区为1m×1m,灌木植物2m×2m,禾木群落10m×10m。在样方区内选择优势种的植物分别采集根、茎、叶。对于农作物、蔬菜及草本植物,在各样区内采5~10个样品。对于灌木和乔木群落应该按草木、灌木、乔木分层采样并编号。在采集测定样品的同时,对优势种还应采集标本以作签定植物科、属之用。一般在各采样小区内采集一个代表样品,此代表样品是在这块地中分散于5~10处,采取5~10个样品混合组成的。采样点的布置方法以梅花形五点取样,或在小区内平行前进以交互间隔方式取样,如图1所示。
4、样品的保存
将采集好的样品装入布口袋,并附上编写好样品号的标签。采集时必须做好野外调查记录和样品采集登记表。对一些特殊情况也应进行记录,以便查对和分析数据时参考。采集好的样品应尽快送往实验室,运输时要注意通风干燥,以防样品发霉腐烂,最好为冷藏运输。用四分法或八分法选取样品。用新鲜样品进行检测时,应立即送往实验室,充分洗涤、捣碎处理和检测。如当天难以处理,鲜检样品应该暂时冷藏在冰箱内。其余样品可在通风干燥处晾干,去掉灰尘、杂物、脱壳、磨碎,通过1mm筛孔,储存在磨口广口玻璃瓶中备用。
动物的各部分组织均可以分别作为采集对象,但通常是用尿、血液、毛发和指甲等。
1、动物的血液
动物一般多用耳缘静脉取血,先去毛,要去净毛,不伤皮肤,用体积分数为75%的酒精擦动物耳朵,例如兔耳朵,用灯泡照射加热使其血管充血,用大头针刺破静脉放血(先从远心端刺),将血液放入抗凝杯中,边收集边摇匀,以防凝固。
2、动物的尿液
为收集动物的尿液,可将动物放在代谢笼中,使动物的尿液可经下漏斗流入采样瓶中。一般晨尿浓度较高,可一次收集,也可收集2h甚至24h的尿液。
3、 头发和指甲
头发作为样品的主要优点是:采样时受检者无痛、无创伤。样品容易贮存和运送,不需特殊容器;样品不易变质,可长期保存等。
在生物样品的测定中,根据测定项目的不同,首先要经过消解(或灰化),或提取和分离等处理工作,然后才能进行待检组分含量的测定。处理生物样品的方法有消解法 (又称湿法氧化或消化法,主要有硝酸-硫酸消解法、硝酸-高氯酸消解法、硫酸-过氧化氢消解法)、灰化法 (又称燃烧法或高温分解法)、提取法(包括振荡提取、组织捣碎、索氏提取器提取)、分离法和浓缩法。
植物待检样品的制备
1、新鲜样品的制备
测定植物样品中易转化或易降解的即易起变化的物质(如酚、氰、有机农药等)及多汁的瓜果、蔬菜样品,应在新鲜状态下进行测定。制备这些样品时,先将各平均样品用清水、去离子水(或重蒸馏水)洗净(受大气污染的样品还应先用洗涤剂洗),并用干净纱布轻轻擦洗。然后切碎、混合均匀。如蔬菜样品可称取100g放入电动捣碎机的捣碎杯中,加同样质量的蒸馏水或去离子水,含水分多的样品也可以不加水(如熟透的西红柿),含水少的样品可加两倍于样品的水。待检样品按实际质量称量。打碎制成均匀浆状。含纤维较多或较硬的样品,如禾本科植物茎秆、叶子等,不能用捣碎机捣碎,可用不锈钢刀或剪刀切成小碎块或碎片,混合均匀备测定用。
2、烘干样品的制备
用干样进行检测的样品通常要经过如下处理:
(1)清除污物
任何灰尘、泥土、肥料、农药等沾污物均会影响测定结果的准确性,所以必须在烘样前擦刷或用清水、0.1%~0.3%的去污物剂和去离子水等清除样品上的污物,清洗的操作必须迅速,以免溶液和样品长时间接触而引起某些成分如钾、钙的损失。
(2)样品的烘干
经擦净或洗净的样品,如果不用鲜样进行测定,最好尽快在鼓风干燥箱(或在低温真空干燥箱中)烘干,以防发霉变质,并减少化学和生物的变化。烘干时要注意适宜的温度,温度过高时,会引起易挥发元素的损失。
(3)样品的研磨
为使样品的组成更为均匀和易于处理,须将烘干的样品进行研磨粉碎并混合均匀,谷类的果实样品须先脱壳再进行粉碎。
用于测定金属元素的样品,研磨时应注意金属器械对样品的污染问题,如测定样品中的铬等含量时,不能用钢制粉碎机,而用玻璃研钵碾碎,过筛最好用尼龙筛,否则会有锰、镍等元素的污染。总之,在测定样品中的微量元素时,最好是使用玛瑙研钵研碎,以免因再次受到污染引起误差。粉碎磨好的样品储存于聚乙烯瓶或磨口广口玻璃瓶中备用。
动物待检样品的制备
1、血、尿待检样品的制备
(1)全血的制备
环境生物测定中所用的全血是抗凝的全血,即在取出人(或动物)的血液后,必须立即与适量的抗凝剂充分混合,以免血液凝固。为了使血液注入容器后均匀的与抗凝剂接触,必须使抗凝剂能在容器底部铺成薄层,这可在烘干时转动容器来实现。取血量为数毫升时一般用试管储血。用上述方法准备的加有抗凝剂的试管称为抗凝试管。
(2)血浆的制备
环境生物污染测定中所用的血浆也是抗凝血浆。制备方法是将抗凝血在离心机中离心,使血细胞下沉,这样所得的上清液即为血浆。在血浆制备过程中应防止溶血,故要求采取血液时所用的注射器、针头等都需清洁干燥,取得全血后也要避免剧烈震动。
(3)血清的制备
血清是指血液凝固后自行析出的液体。制备血清的方法是采取血液,不加抗凝剂,在室温下使其凝固,通常经3h后血块收缩析出血清,离心分离,吸取上清液即为血清。制备血清也要防止溶血,故所用设备必须干燥,且在血块收缩后及早分出血清。
(4)无蛋白质血液的制备
在环境生物污染测定中有时须避免蛋白质的干扰(常与试剂发生浑浊或沉淀),常用沉淀蛋白质的试剂除去血液中的蛋白质,而保留应测定的化学成分,这种操作称为无蛋白血液的制备。无蛋白血滤液的制备应根据具体检测要求来选择沉淀蛋白质的试剂。
2、动物组织和器官待检样品的制备
离体不久的组织在适宜的温度和pH值条件下,可以进行一定程度的物质代谢。所以在生物测定中,常利用离体组织制成不同的组织样品,用来研究生物化学变化。常用的组织制品有:组织糜、组织匀浆、组织提取液。
(1)组织糜:将新鲜组织用剪刀迅速剪碎,再与砂及适当的缓冲液磨碎或用绞肉机绞成糜状。
(2)组织匀浆:新鲜组织称量后剪碎,加入适当的匀浆制备液,用高速组织捣碎机搅碎组织而制成匀浆。如果组织量较少,可在剪碎组织后用组织匀浆器磨成匀浆。
(3)组织提取液 将组织匀浆经过细纱布过滤的液体或经离心去沉淀后的上清液,即为组织提取液。