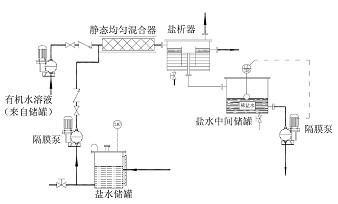
-
分段盐析 编辑
中文名:分段盐析
目的:将混合液中的蛋白质逐步盐析分开
对分离目的蛋白的盐析,最好采用分段盐析。由于不同的蛋白质其溶解度与等电点不同,沉淀时所需的pH值与离子强度也不相同,改变盐的浓度与溶液的pH值,可将混合液中的蛋白质分批盐析分开,这种分离蛋白质的方法称为分段盐析法(fraCTional saltingout)。如半饱和硫酸铵可沉淀血浆球蛋白,饱和硫酸铵则可沉淀包括血浆清蛋白在内的全部蛋白质。
蛋白质是亲水胶体,借水化膜和同性电荷(在PH值7.0的溶液中一般蛋白质带负电荷)维持胶体的稳定性。向蛋白质溶液中加入某种碱金属或碱土金属的中性盐类,则发生电荷中和现象(失去电荷)。当盐类的浓度足够大时,蛋白质胶粒脱水而沉淀,称为盐析。由盐析所得的顼沉淀,经过透析或用水稀释以减低或除去盐后,能再溶解并恢复其分子原有结构及生物活性,因此由盐析生成的沉淀是可逆性沉淀。各种蛋白质分子颗粒大小、亲水度不同,故盐析所需耍的盐浓度也不一样。调节混合蛋白质溶液中盐的浓度.可使各种蛋白质分段沉淀。球蛋白在个饱和硫酸铵溶液中即可析出,白蛋白则需在饱和硫酸铵溶液中才能沉淀,此法是蛋白质分离纯化过程中的常用方法。
蛋白质的分子很大,其颗粒在胶体颗粒范围(直径1~100nm)内,所以不能透过半透膜。选孔径合宜的半透膜,由于小分子物质能够透过,而蛋白质颗粒不能透过,因此可使蛋白质和小分子物质分开。这种方法可除去和蛋白质混合的中性盐及其他小分子物质。这种技术叫做透析,是常用来纯化蛋白质的方法。由盐析所得的蛋白质沉淀,经过透析脱盐后仍可恢复其原有结构及生物活性。