-
溶解度 编辑
2.气体的溶解度通常指的是该气体(其压强为1标准大气压)在一定温度时溶解在1体积溶剂里的体积数。也常用“g/100g溶剂”作单位(自然也可用体积)。
3.特别注意:溶解度的单位是克(或者是克/100克溶剂)而不是没有单位。
在一定的温度和压力下,物质在一定量的溶剂中溶解的最高量。一般以100克溶剂中能溶解物质的克数来表示。一种物质在某种溶剂中的溶解度主要决定于溶剂和溶质的性质,即溶质在溶剂的溶解平衡常数。例如,水是最普通最常用的溶剂,甲醇和乙醇可以任何比例与水互溶。大多数碱金属盐类都可以溶于水;苯几乎不溶于水。
溶解度明显受温度的影响,大多数固体物质的溶解度随温度的升高而增大;气体物质的溶解度则与此相反,随温度的升高而降低。 溶解度与温度的依赖关系可以用溶解度曲线来表示。氯化钠NaCl的溶解度随温度的升高而缓慢增大,硝酸钾KNO3的溶解度随温度的升高而迅速增大,而硫酸钠Na2SO4的溶解度却随温度的升高而减小。固体和液体的溶解度基本不受压力的影响,而气体在液体中的溶解度与气体的分压成正比。 物质的溶解度对于化学和化学工业都很重要,在固体物质的重结晶和分级结晶、化学物质的制备和分离、混合气体的分离等工艺中都要利用物质溶解度的差别。
在一定温度下,某物质在100g溶剂里达到饱和状态(或称溶解平衡)时所溶解的克数,叫做这种物质在这种溶剂里的溶解度。在一定温度和压强下,物质在一定量的溶剂中溶解的最大量,叫做这种物质在这种溶剂里的溶解度。溶解性是表示一种物质在另一种物质中的溶解能力,通常用易溶、可溶、微溶、难溶或不溶等粗略的概念来表示。溶解度是衡量物质在溶剂里溶解性大小的尺度,是溶解性的定量表示。
溶解度常用符号S表示。溶解度的单位用g/100gH2O表示。例如20℃,在100g水里最多溶解36gNaCl,则氯化钠在20℃的溶解度是36g/100gH2O,可表示为S(NaCl)=36g/100gH2O。实际上溶解度是没有单位的相对比值,按法定计量单位,可用质量分数表示。例如在20℃,S(NaCl)=0.36。溶解度也可以用饱和溶液的浓度表示。例如,氯化钾在20℃的溶解度是4.627mol/1000gH2O(此浓度为质量摩尔浓度),即表示20℃在1000g水中最多可溶解4.627mol的氯化钾。难溶物质的溶解度也可以用物质的量浓度(摩尔浓度)表示。例如在25℃,氢氧化铁的物质的量浓度是0.45μmol/L,即表示1L氢氧化铁饱和溶液里含0.45μmol氢氧化铁。多数固体物质的溶解度随温度的上升而增大,如氯化铵、硝酸钾。少数物质的溶解度受温度变化的影响很小,如氯化钠。含有结晶水的硫酸钠(Na₂SO₄·10H₂O)的溶解度开始随温度的升高而增大,当达到一定温度(32.4℃)时,随温度的升高而减小(这时Na2SO4·10H2O脱水成Na2SO4)。含有结晶水的氢氧化钙和醋酸钙等物质的溶解度随温度的升高而减小。气体的溶解度随温度的升高而减小,随压强的增大而增大。影响溶解度的因素为温度。
固体溶解度
固体物质的能容溶解度是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的质量,用字母S表示,其单位是“g/100g水”。在未注明的情况下,通常溶解度指的是物质在水里的溶解度。例如:在20℃时,100g水里最多能溶36g氯化钠(这时溶液达到饱和状态),在20℃时,氯化钠在水里的溶解度是36g。
气体溶解度
在一定温度和压强下,气体在一定量溶剂中溶解的最高量称为气体的溶解度。常用定温下1体积溶剂中所溶解的最多体积数来表示。如20℃时100mL水中能溶解1.82mL氢气,则表示为1.82mL/100mL水等。气体的溶解度除与气体本性、溶剂性质有关外,还与温度、压强有关,其溶解度一般随着温度升高而减少,由于气体溶解时体积变化很大,故其溶解度随压强增大而显著增大。关于气体溶解于液体的溶解度,在1803年英国化学家W.亨利,根据对稀溶液的研究总结出一条定律,称为亨利定律。
实例
大部分固体随温度升高溶解度增大,如硝酸钾。
少部分固体溶解度受温度影响不大,如食盐(氯化钠)。
极少数物质溶解度随温度升高反而减小,如氢氧化钙。因为氢氧化钙有两种水合物〔Ca(OH)₂·2H₂O和Ca(OH)₂·12H₂O〕。这两种水合物的溶解度较大,无水氢氧化钙的溶解度很小。随着温度的升高,这些结晶水合物逐渐变为无水氢氧化钙,所以,氢氧化钙的溶解度就随着温度的升高而减小。除了氢氧化钙还有别的物质溶解度也随温度的升高而减小,比如说硫酸锂。
在未注明的情况下,通常溶解度指的是物质在水里的溶解度。如20℃时,食盐的溶解度是36克,氯化钾的溶解度是34克。这些数据可以说明20℃时,食盐和氯化钾在100克水里最大的溶解量分别为36克和34克;也说明在此温度下,食盐在水中比氯化钾的溶解能力强。
通常把在室温(20°C)下,溶解度在10g/100g水以上的物质叫易溶物质,溶解度在1~10g/100g水叫可溶物质,溶解度在0.01g~1g/100g水的物质叫微溶物质,溶解度小于0.01g/100g水的物质叫难溶物质。可见溶解是绝对的,不溶解是相对的。
气体的溶解度还和压强有关。压强越大,溶解度越大,反之则越小。
其他条件一定时,温度越高,气体溶解度越低。
另外,溶解度不同于溶解速度。搅拌、振荡、粉碎颗粒等增大的是溶解速度,但不能增大溶解度。溶解度也不同于溶解的质量,溶剂的质量增加,能溶解的溶质质量也增加,但溶解度不会改变。
实际上,溶解度往往取决于溶质在水中的溶解平衡常数。这是平衡常数的一种,反映溶质的溶解-沉淀平衡关系,当然它也可以用于沉淀过程(那时它叫溶度积)。因此,溶解度与温度关系很大,也就不难解释了。达到化学平衡的溶液便不能容纳更多的溶质(当然,其他溶质仍能溶解),我们称之为饱和溶液。在特殊条件下,溶液中溶解的溶质会比正常情况多,这时它便成为过饱和溶液。在一定温度和压力下,物质在一定量溶剂中溶解的最大量。
固体或液体溶质的溶解度,常用100克溶剂中所溶解的溶质克数表示。例如在20℃和常压下,硝酸钾在水中的溶解度是31.5克/100克水,或简称31.5克。气体溶质的溶解度,常用每毫升溶剂中所溶解的气体毫升数表示。例如在20℃和常压下,氨的溶解度是700毫升/1毫升水。物质的溶解度除与溶质和溶剂的性质有关外,还与温度、压力等条件有关。随着温度的升高,大多数固体和液体的溶解度增大,气体的则减小。随着压力的增大,气体的溶解度增大。
气体的溶解度大小,首先决定于气体的性质,同时也随着气体的压强和溶剂的温度的不同而变化。例如,在20℃时,气体的压强为1.013×105Pa,一升水可以溶解气体的体积是:氨气为702L,氢气为0.01819L,氧气为0.03102L。氨气易溶于水,是因为氨气是极性分子,水也是极性分子,而且氨气分子跟水分子还能形成氢键,发生显著的水合作用,所以,它的溶解度很大;而氢气、氧气都是非极性分子,所以在水里的溶解度很小。
当压强一定时,气体的溶解度随着温度的升高而减少。这一点对气体来说没有例外,因为当温度升高时,气体分子运动速率加快,容易自水面逸出。
当温度一定时,气体的溶解度随着气体的压强的增大而增大。这是因为当压强增大时,液面上的气体的浓度增大,因此,进入液面的气体分子比从液面逸出的分子多,从而使气体的溶解度变大。而且,气体的溶解度和该气体的压强(分压)在一定范围内成正比(在气体不跟水发生化学变化的情况下)。例如,在20℃时,氢气的压强是1.013×105Pa,氢气在一升水里的溶解度是0.01819L;同样在20℃,在2×1.013×105Pa时,氢气在一升水里的溶解度是0.01819×2=0.03638L。
气体的溶解度有两种表示方法,一种是在一定温度下,气体的压强(或称该气体的分压,不包括水蒸气的压强)是1.013×105Pa时,溶解于一体积水里,达到饱和的气体的体积(并需换算成在0℃时的体积数),即这种气体在水里的溶解度。另一种气体的溶解度的表示方法是,在一定温度下,该气体在100g水里, 气体的总压强为1.013×105Pa(气体的分压加上当时水蒸气的压强)所溶解的克数。
夏天打开汽水瓶盖时,压强减小,气体的溶解度减小,会有大量气体涌出。
喝汽水后会打嗝,因为汽水到胃中后,温度升高,气体的溶解度减小。
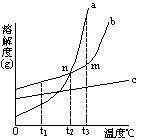
溶解度曲线的意义与应用可从点、线、面和交点四方面来分析。
1.点溶解度曲线上的每个点表示的是某温度下某种物质的溶解度。即曲线上的任意一点都对应有相应的温度和溶解度。温度在横坐标上可以找到,溶解度在纵坐标上可以找到。溶解度曲线上的点有三个方面的作用: (1)根据已知温度查出有关物质的溶解度;(2)根据物质的溶解度查出对应的温度;(3)比较相同温度下不同物质溶解度的大小或者饱和溶液中溶质的质量分数的大小。
2.线
溶解度曲线表示某物质在不同温度下的溶解度或溶解度随温度的变化情况。曲线的坡度越大,说明溶解度受温度影响越大;反之,说明受温度影响较小。溶解度曲线也有三个方面的应用:(1)根据溶解度曲线,可以看出物质的溶解度随着温度的变化而变化的情况。 (2)根据溶解度曲线,比较在一定温度范围内的物质的溶解度大小。 (3)根据溶解度曲线,选择分离某些可溶性混合物的方法。
3.面
对于曲线下部面积上的任何点,依其数据配制的溶液为对应温度时的不饱和溶液;曲线上部面积上的点,依其数据配制的溶液为对应温度时的饱和溶液,且溶质有剩余。如果要使不饱和溶液(曲线下部的一点)变成对应温度下的饱和溶液,方法有两种:第一种方法是向该溶液中添加溶质使之到达曲线上;第二种方法是蒸发一定量的溶剂。4.交点
两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
常见气体溶解度
氨气>氯化氢>二氧化硫>硫化氢>氯气>二氧化碳>氧气>氢气>甲烷,一氧化碳
(极易溶解于水) (易溶解于水) (能溶解于水) (难) (极难)
特征
(1)大部分固体物质的溶解度曲线左低右高,溶解度随温度的升高而增加;(2)少数固体物质的溶解度曲线较平缓,溶解度受温度的影响小,如食盐;
(3)极少数固体物质的溶解度曲线是左高右低,溶解度随温度的升高而降低,如熟石灰;
用溶解性表示物质的溶解能力是定性的,粗略的。
应用
(1)由已知温度查某物质对应的溶解度;
(2)由物质的溶解度查该物质所处的温度;
(3)比较同一温度下不同物质的溶解度;比较同一物质在不同温度下的溶解度。
(4)比较和确定物质的溶解度受温度影响的程度,并据此设计混合物分离或提纯的方法,例如提纯NaCl可用蒸发溶剂法,分离NaCl和NaNO₃可用降温结晶法。
(5)能够判断在一定温度下某物质饱和溶液中溶质、溶剂、溶液的质量比。
(6)判断在一定温度下把一定量的溶质溶解在一定量的溶剂里所形成的溶液是否为饱和溶液。
(7)根据物质在20℃的溶解度来确定物质的溶解度大小。
(8)确定溶液的状态(饱和与不饱和)。
质量分数类型
大致包括以下四种类型:(1)已知溶质和溶剂的量,求溶质的质量分数;
(2)要配制一定量的溶质的质量分数一定的溶液,计算所需溶质和溶剂的量;
(3)溶液稀释和配制问题的计算;
(4)把溶质的质量分数运用于化学方程式的计算。
溶质的质量分数的计算方式:
溶质的质量分数=(溶质质量/溶液质量)*100% = *100%
例 10克氯化钠溶解于90克水中,则在所得氯化钠溶液中溶质的质量分数=10/100=10%
溶液的稀释
根据稀释前后溶质的总量不变进行运算,无论是用水,或是用稀溶液来稀释浓溶液,都可计算。
(1)用水稀释浓溶液
设稀释前的浓溶液的质量为m,其溶质的质量分数为a%,稀释时加入水的质量为n,稀释后溶质的质量分数为b%。
则可得m×a%=(m+n)×b%
(2)用稀溶液稀释浓溶液
设浓溶液的质量为A,其溶质的质量分数为a%,稀溶液的质量为B,其溶质的质量分数为b%,两液混合后的溶质的质量分数为c%。
则可得 A×a%+B×b%=(A+B)×c% (1)
或 A/B=(c%-b%)/(a%-c%) (2)
溶质的质量分数=溶质质量/溶液质量×100%
固体溶解度之一
在一定温度下,某固态物质在100g溶剂里达到饱和时所溶解的克数,叫做这种物质在这种溶剂里的溶解度。符号:S
固体溶解度之二
在一定温度下,一定量的饱和溶液中含有固体溶质的量称为该固体物质在指定温度下的溶解度。通常以一定温度下,物质在100g溶剂中达到饱和时所溶解的克数来表示某物质在该溶剂中的溶解度,如20℃时,100g水中最多能溶解35.8g氯化钠,即该温度下氯化钠的溶解度为35.8g/100g水。固体物质的溶解度与溶质、溶剂的本性有关,通常溶质的结构与溶剂的结构相似时较易溶解,即所谓相似相溶原理,它可解释部分事实。大多数固体物质的溶解度随温度升高而增大,温度对不同的物质影响不同,可根据物质溶解度与温度的关系作出溶解度曲线,利用溶解度曲线可找出在任何温度时,某物质的溶解度,也可利用溶解度曲线提纯、分离某些物质。固体物质的溶解度受压力影响较小。
物质的溶解性
溶解性 | 溶解度(20℃) |
|---|---|
易溶 | 大于等于10g |
可溶 | 大于等于1g小于10g |
微溶 | 大于等于0.01g小于1g |
难溶(不溶) | 小于0.01g |
锕、氨、铵
物质 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
氢氧化锕(III) | Ac(OH)₃ | 0.0022 | ||||||||||
氨 | NH₃ | 88.5 | 70 | 56 | 44.5 | 34 | 26.5 | 20 | 15 | 11 | 8 | 7 |
叠氮化铵 | NH₄N₃ | 16 | 25.3 | 37.1 | ||||||||
苯甲酸铵 | NH₄C7H5O₂ | 20 | ||||||||||
碳酸氢铵 | NH₄HCO₃ | 11.9 | 16.1 | 21.7 | 28.4 | 36.6 | 59.2 | 109 | 170 | 354 | ||
溴化铵 | NH₄Br | 60.6 | 68.1 | 76.4 | 83.2 | 91.2 | 108 | 125 | 135 | 145 | ||
碳酸铵 | (NH₄)₂CO₃ | 100 | ||||||||||
氯酸铵 | NH₄ClO₃ | 28.7 | ||||||||||
氯化铵 | NH₄Cl | 29.4 | 33.2 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 60.2 | 65.6 | 71.2 | 77.3 |
氯铂酸铵 | (NH₄)₂PtCl6 | 0.289 | 0.374 | 0.499 | 0.637 | 0.815 | 1.44 | 2.16 | 2.61 | 3.36 | ||
铬酸铵 | (NH₄)₂CrO₄ | 25 | 29.2 | 34 | 39.3 | 45.3 | 59 | 76.1 | ||||
重铬酸铵 | (NH₄)₂Cr₂O7 | 18.2 | 25.5 | 35.6 | 46.5 | 58.5 | 86 | 115 | 156 | |||
砷酸二氢铵 | NH₄H₂AsO₄ | 33.7 | 48.7 | 63.8 | 83 | 107 | 122 | |||||
磷酸二氢铵 | NH₄H₂PO₄ | 22.7 | 39.5 | 37.4 | 46.4 | 56.7 | 82.5 | 118 | 173 | |||
氟硅酸铵 | (NH₄)₂SiF6 | 18.6 | ||||||||||
甲酸铵 | NH₄HCO₂ | 102 | 143 | 204 | 311 | 533 | ||||||
磷酸一氢铵 | (NH₄)₂HPO₄ | 42.9 | 62.9 | 68.9 | 75.1 | 81.8 | 97.2 | |||||
硫酸氢铵 | NH₄HSO₄ | 100 | ||||||||||
酒石酸氢铵 | NH₄HC4H4O6 | 1.88 | 2.7 | |||||||||
碘酸铵 | NH4IO3 | 2.6 | ||||||||||
碘化铵 | NH4I | 155 | 163 | 172 | 182 | 191 | 209 | 229 | 250 | |||
NH4NO3 | 118 | 150 | 192 | 242 | 297 | 421 | 580 | 740 | 871 | |||
高碘酸铵 | (NH4)5IO6 | 2.7 | ||||||||||
草酸铵 | (NH4)2C2O4 | 2.2 | 3.21 | 4.45 | 6.09 | 8.18 | 14 | 22.4 | 27.9 | 34.7 | ||
高氯酸铵 | NH4ClO4 | 12 | 16.4 | 21.7 | 37.7 | 34.6 | 49.9 | 68.9 | ||||
高锰酸铵 | NH4MnO4 | 7.9 | ||||||||||
磷酸铵 | (NH4)3PO4 | 26.1 | ||||||||||
硒酸铵 | (NH4)2SeO4 | 96 | 105 | 115 | 126 | 143 | 192 | |||||
(NH4)2SO4 | 70.6 | 73 | 75.4 | 78 | 81 | 88 | 95 | 103 | ||||
亚硫酸铵 | (NH4)2SO3 | 47.9 | 54 | 60.8 | 68.8 | 78.4 | 104 | 144 | 150 | 153 | ||
酒石酸铵 | (NH4)2C4H4O6 | 45 | 55 | 63 | 70.5 | 76.5 | 86.9 | |||||
硫氰酸铵 | NH4SCN | 120 | 144 | 170 | 208 | 234 | 346 | |||||
硫代硫酸铵 | (NH4)2S2O3 | 2.15 | ||||||||||
钒酸铵 | NH4VO3 | 0.48 | 0.84 | 1.32 | 2.42 |
钯、钡、铋、铂、钚
物质 | 化学式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
氢氧化钯(II) | Pd(OH)2 | 4.106×10 | ||||||||||
氢氧化钯(IV) | Pd(OH)4 | 5.247×10 | ||||||||||
乙酸钡 | Ba(C2H3O2)2 | 58.8 | 62 | 72 | 75 | 78.5 | 75 | 74 | 74.8 | |||
砷酸钡 | Ba3(AsO4)2 | 2.586×10 | ||||||||||
叠氮化钡 | Ba(N3)2 | 12.5 | 16.1 | 17.4 | ||||||||
溴酸钡 | Ba(BrO3)2 | 0.29 | 0.44 | 0.65 | 0.95 | 1.31 | 2.27 | 3.52 | 0.95 | 1.31 | ||
溴化钡 | BaBr2 | 98 | 101 | 104 | 109 | 114 | 123 | 135 | 149 | |||
BaCO3 | 1.409×10 | |||||||||||
氯酸钡 | Ba(ClO3)2 | 20.3 | 26.9 | 33.9 | 41.6 | 49.7 | 66.7 | 84.8 | 105 | |||
氯化钡 | BaCl2 | 31.2 | 33.5 | 35.8 | 38.1 | 40.8 | 46.2 | 52.5 | 55.8 | 59.4 | ||
氯酸钡 | Ba(ClO2)2 | 43.9 | 44.6 | 45.4 | 47.9 | 53.8 | 66.6 | 80.8 | ||||
铬酸钡 | BaCrO4 | 2.775×10 | ||||||||||
氰化钡 | Ba(CN)2 | 80 | ||||||||||
亚铁氰化钡 | Ba2Fe(CN)6 | 9.732×10 | ||||||||||
氟化钡 | BaF2 | 0.159 | 0.16 | 0.162 | ||||||||
氟硅酸钡 | BaSiF6 | 2.8×10 | ||||||||||
甲酸钡 | Ba(HCO2)2 | 26.2 | 28 | 31.9 | 34 | 38.6 | 44.2 | 47.6 | 51.3 | |||
磷酸氢钡 | BaHPO4 | 1.3×10 | ||||||||||
亚磷酸氢钡 | BaHPO3 | 0.687 | ||||||||||
Ba(OH)2·8H2O | 1.67 | 2.48 | 3.89 | 5.59 | 8.22 | 20.9 | 101 | |||||
碘酸钡 | Ba(IO3)2 | 3.5×10 | 4.6×10 | 5.7×10 | ||||||||
碘化钡 | BaI2 | 182 | 201 | 223 | 250 | 264 | 291 | 301 | ||||
钼酸钡 | BaMoO4 | 6×10 | ||||||||||
硝酸钡 | Ba(NO3)2 | 4.95 | 6.67 | 9.02 | 11.5 | 14.1 | 20.4 | 27.2 | 34.4 | |||
亚硝酸钡 | Ba(NO2)2 | 50.3 | 60 | 72.8 | 102 | 151 | 222 | 261 | 325 | |||
草酸钡 | BaC2O4·2H2O | 3×10 | ||||||||||
氧化钡 | BaO | 3.8 | ||||||||||
高氯酸钡 | Ba(ClO4)2 | 239 | 336 | 416 | 495 | 575 | 653 | |||||
高锰酸钡 | Ba(MnO4)2 | 1.5×10 | ||||||||||
焦磷酸钡 | Ba2P2O7 | 9×10 | ||||||||||
硒酸钡 | BaSeO4 | 5×10 | ||||||||||
BaSO4 | 2.448×10 | |||||||||||
硫化钡 | BaS | 2.88 | 4.89 | 7.86 | 10.4 | 14.9 | 27.7 | 49.9 | 67.3 | 60.3 | ||
砷酸铋 | BiAsO4 | 7.298×10 | ||||||||||
氢氧化铋 | Bi(OH)3 | 2.868×10 | ||||||||||
碘化铋 | BiI3 | 7.761×10 | ||||||||||
磷酸铋 | BiPO4 | 1.096×10 | ||||||||||
硫化铋 | Bi2S3 | 1.561×10 | ||||||||||
氢氧化铂(II) | Pt(OH)2 | 3.109×10 | ||||||||||
溴化铂(IV) | PtBr4 | 1.352×10 | ||||||||||
氟化钚(III) | PuF3 | 3.144×10 | ||||||||||
氟化钚(IV) | PuF4 | 3.622×10 | ||||||||||
碘酸钚(IV) | Pu(IO3)4 | 7.998×10 |
氮、镝
物质 | 化学式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
NO | 5.6×10 | |||||||||||
一氧化二氮 | N2O | 0.112 | ||||||||||
铬酸镝(III) | Dy2(CrO4)3·10H2O | 0.663 |
铒
物质 | 化学式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
氢氧化铒(III) | Er(OH)3 | 1.363×10 |
钒
物质 | 化学式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
五氧化二钒 | V2O5 | 0.8 |
钆、钙、锆、镉、铬、汞、钴、硅
物质 | 化学式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
乙酸钆(III) | Gd(C2H3O2) ·4H2O | 11.6 | ||||||||||
碳酸氢钆(III) | Gd(HCO3)3 | 5.61 | ||||||||||
溴酸钆(III) | Gd(BrO3)3 ·9H2O | 50.2 | 70.1 | 95.6 | 126 | 166 | ||||||
氢氧化钆(III) | Gd(OH)3 | 1.882×10 | ||||||||||
硫酸钆(III) | Gd2(SO4)3 | 3.98 | 3.3 | 2.6 | 2.32 | |||||||
氯化钙 | CaCl2 | 59.5 | 64.7 | 74.5 | 100 | 128 | 137 | 147 | 154 | 159 | ||
Ca(C2H3O2)2 ·2H2O | 37.4 | 36 | 34.7 | 33.8 | 33.2 | 32.7 | 33.5 | 31.1 | 29.7 | |||
砷酸钙 | Ca3(AsO4)2 | 3.629×10 | ||||||||||
叠氮化钙 | Ca(N3)2 | 45 | ||||||||||
苯甲酸钙 | Ca(C7H5O2)2 ·3H2O | 2.32 | 2.45 | 2.72 | 3.02 | 3.42 | 4.71 | 6.87 | 8.55 | 8.7 | ||
碳酸氢钙 | Ca(HCO3)2 | 16.1 | 16.6 | 17.1 | 17.5 | 17.9 | 18.4 | |||||
溴酸钙 | Ca(BrO3)2 | 230 | ||||||||||
溴化钙 | CaBr2 | 125 | 132 | 143 | 213 | 278 | 295 | 312 | ||||
霰石 | CaCO3-霰石 | 7.753×10 | ||||||||||
方解石 | CaCO3-方解石 | 6.170×10 | ||||||||||
氯酸钙 | Ca(ClO3)2 | 209 | ||||||||||
铬酸钙 | CaCrO4 | 4.5 | 2.25 | 1.83 | 1.49 | 0.83 | ||||||
磷酸二氢钙 | Ca(H2PO4)2 | 1.8 | ||||||||||
氟化钙 | CaF2 | 8.575×10 | ||||||||||
氟硅酸钙 | CaSiF6 | 0.518 | ||||||||||
甲酸钙 | Ca(HCO2)2 | 16.1 | 16.6 | 17.1 | 17.5 | 17.9 | 18.4 | |||||
CaHPO4 | 4.303×10 | |||||||||||
氢氧化钙 | Ca(OH)2 | 0.189 | 0.182 | 0.173 | 0.16 | 0.141 | 0.121 | 8.6×10 | 7.6×10 | |||
碘酸钙 | Ca(IO3)2 | 9×10 | 0.24 | 0.38 | 0.52 | 0.65 | 0.66 | 0.67 | ||||
碘化钙 | CaI2 | 64.6 | 66 | 67.6 | 70.8 | 74 | 78 | 81 | ||||
钼酸钙 | CaMoO4 | 4.099×10 | ||||||||||
硝酸钙 | Ca(NO3)2 ·4H2O | 102 | 115 | 129 | 152 | 191 | 358 | 363 | ||||
亚硝酸钙 | Ca(NO2)2 ·4H2O | 63.9 | 84.5 | 104 | 134 | 151 | 166 | 178 | ||||
草酸钙 | CaC2O4 | 6.7×10 | ||||||||||
高氯酸钙 | Ca(ClO4)2 | 188 | ||||||||||
高锰酸钙 | Ca(MnO4)2 | 338 | ||||||||||
Ca3(PO4)2 | 2×10 | |||||||||||
硒酸钙 | CaSeO4·2H2O | 9.73 | 9.77 | 9.22 | 8.79 | 7.14 | ||||||
CaSO4·2H2O | 0.223 | 0.244 | 0.255 | 0.264 | 0.265 | 0.244 | 0.234 | 0.205 | ||||
CaWO4 | 2.387×10-3 | |||||||||||
氟化锆 | ZrF4 | 1.32 | ||||||||||
硫酸锆 | Zr(SO4)2·4H2O | 52.5 | ||||||||||
砷酸镉 | Cd3(AsO4)2 | 7.091×10-6 | ||||||||||
苯甲酸镉 | Cd(C7H5O2)2 | 2.81 | ||||||||||
溴酸镉 | Cd(BrO3)2 | 125 | ||||||||||
溴化镉 | CdBr2 | 56.3 | 75.4 | 98.8 | 129 | 152 | 153 | 156 | 160 | |||
碳酸镉 | CdCO3 | 3.932×10 | ||||||||||
氯酸镉 | Cd(ClO3)2 | 299 | 308 | 322 | 348 | 376 | 455 | |||||
氯化镉 | CdCl2 | 100 | 135 | 135 | 135 | 135 | 136 | 140 | 147 | |||
氰化镉 | Cd(CN)2 | 2.2×10 | ||||||||||
亚铁氰化镉 | Cd2Fe(CN)6 | 8.736×10 | ||||||||||
氟化镉 | CdF2 | 4 | ||||||||||
甲酸镉 | Cd(HCO2)2 | 8.3 | 11.1 | 14.4 | 18.6 | 25.3 | 59.5 | 80.5 | 85.2 | 94.6 | ||
氢氧化镉 | Cd(OH)2 | 2.697×10 | ||||||||||
碘酸镉 | Cd(IO3)2 | 9.7×10 | ||||||||||
碘化镉 | CdI2 | 78.7 | 84.7 | 87.9 | 92.1 | 100 | 111 | 125 | ||||
硝酸镉 | Cd(NO3)2 | 122 | 136 | 150 | 194 | 310 | 713 | |||||
草酸镉 | CdC2O4.3H2O | 6.046×10 | ||||||||||
高氯酸镉 | Cd(ClO4)2 | 180 | 188 | 195 | 203 | 221 | 243 | 272 | ||||
磷酸镉 | Cd3(PO4)2 | 6.235×10 | ||||||||||
硒酸镉 | CdSeO4 | 72.5 | 68.4 | 64 | 58.9 | 55 | 44.2 | 32.5 | 27.2 | 22 | ||
硫酸镉 | CdSO4 | 75.4 | 76 | 76.6 | 78.5 | 81.8 | 66.7 | 63.1 | 60.8 | |||
硫化镉 | CdS | 1.292×10 | ||||||||||
钨酸镉 | CdWO4 | 4.642×10 | ||||||||||
硝酸铬 | Cr(NO3)3 | 108 | 124 | 130 | 152 | |||||||
高氯酸铬 | Cr(ClO4)3 | 104 | 123 | 130 | ||||||||
硫酸铬 | Cr2(SO4)3 ·18H2O | 220 | ||||||||||
叠氮化亚汞 | Hg2(N3)2 | 2.727×10 | ||||||||||
溴化亚汞 | Hg2Br2 | 1.352×10 | ||||||||||
碳酸亚汞 | Hg2CO3 | 4.351×10 | ||||||||||
氯化亚汞 | Hg2Cl2 | 3.246×10 | ||||||||||
铬酸亚汞 | Hg2CrO4 | 2.313×10 | ||||||||||
氰化亚汞 | Hg2(CN)2 | 2.266×10 | ||||||||||
高氯酸亚汞 | Hg2(ClO4)2) | 282 | 325 | 407 | 455 | 499 | 541 | 580 | ||||
硫酸亚汞 | Hg2SO4 | 4.277×10 | ||||||||||
乙酸汞 | Hg(C2H3O2)2 | 25 | ||||||||||
苯甲酸汞 | Hg(C7H5O2)2 ·H2O | 1.1 | ||||||||||
溴酸汞 | Hg(BrO3)2 ·2H2O | 0.08 | ||||||||||
溴化汞 | HgBr2 | 0.3 | 0.4 | 0.56 | 0.66 | 0.91 | 1.68 | 2.77 | 4.9 | |||
氯酸汞 | Hg(ClO3)2 | 25 | ||||||||||
HgCl2 | 3.63 | 4.82 | 6.57 | 8.34 | 10.2 | 16.3 | 30 | 61.3 | ||||
氰化汞 | Hg(CN)2 | 9.3 | ||||||||||
碘酸汞 | Hg(IO3)2 | 2.372×10 | ||||||||||
碘化汞 | HgI2 | 6×10 | ||||||||||
草酸汞 | HgC2O4 | 1.1×10 | ||||||||||
硫化汞 | HgS | 2.943×10 | ||||||||||
硫氰酸汞 | Hg(SCN)2 | 6.3×10 | ||||||||||
溴酸钴 | Co(BrO3)2 ·6H2O | 45.5 | ||||||||||
溴化钴 | CoBr2 | 91.9 | 112 | 128 | 163 | 227 | 241 | 257 | ||||
氯酸钴 | Co(ClO3)2 | 135 | 162 | 180 | 195 | 214 | 316 | |||||
氯化钴 | CoCl2 | 43.5 | 47.7 | 52.9 | 59.7 | 69.5 | 93.8 | 97.6 | 101 | 106 | ||
氟化钴 | CoF2 | 1.36 | ||||||||||
氟硅酸钴 | CoSiF6 ·6H2O | 118 | ||||||||||
碘酸钴 | Co(IO3)2 ·2H2O | 1.02 | 0.9 | 0.88 | 0.82 | 0.73 | 0.7 | |||||
碘化钴 | CoI2 | 203 | ||||||||||
硝酸钴 | Co(NO3)2 | 84 | 89.6 | 97.4 | 111 | 125 | 174 | 204 | 300 | |||
亚硝酸钴 | Co(NO2)2 | 7.6×10 | 0.24 | 0.4 | 0.61 | 0.85 | ||||||
高氯酸钴 | Co(ClO4)2 | 104 | ||||||||||
硫酸钴 | CoSO4 | 25.5 | 30.5 | 36.1 | 42 | 48.8 | 55 | 53.8 | 45.3 | 38.9 | ||
SiO2 | 0 |
铪、氦、钬
物质 | 化学式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
氢氧化铪(III) | Hf(OH)3 | 4.50305×10 | ||||||||||
氢氧化铪(IV) | Hf(OH)4 | 4.503×10 | ||||||||||
氦 | He | 0.6 | ||||||||||
氢氧化钬(III) | Ho(OH)3 | 2.519×10 | ||||||||||
硫酸钬(III) | Ho2(SO4)3·8H2O | 8.18 | 6.1 | 4.52 |
镓、钾、金
物质 | 化学式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
氢氧化镓 | Ga(OH)3 | 8.616×10 | ||||||||||
草酸镓 | Ga2(C2O4)3·42O | 0.4 | ||||||||||
硒酸镓 | Ga2(SeO4)3·16H2O | 18.1 | ||||||||||
乙酸钾 | KC2H3O2 | 216 | 233 | 256 | 283 | 324 | 350 | 381 | 398 | |||
砷酸钾 | K3AsO4 | 19 | ||||||||||
叠氮化钾 | KN3 | 41.4 | 46.2 | 50.8 | 55.8 | 61 | 106 | |||||
苯甲酸钾 | KC7H5O2 | 65.8 | 70.7 | 76.7 | 82.1 | |||||||
溴酸钾 | KBrO3 | 3.09 | 4.72 | 6.91 | 9.64 | 13.1 | 22.7 | 34.1 | 49.9 | |||
溴化钾 | KBr | 53.6 | 59.5 | 65.3 | 70.7 | 75.4 | 85.5 | 94.9 | 99.2 | 104 | ||
溴铂酸钾 | K2PtBr6 | 1.89 | ||||||||||
碳酸钾 | K2CO3 | 105 | 109 | 111 | 114 | 117 | 127 | 140 | 148 | 156 | ||
氯酸钾 | KClO3 | 3.3 | 5.2 | 7.3 | 10.1 | 13.9 | 23.8 | 37.5 | 46 | 56.3 | ||
氯化钾 | KCl | 28 | 31.2 | 34.2 | 37.2 | 40.1 | 45.8 | 48.8 | 51.3 | 53.9 | 56.3 | |
铬酸钾 | K2CrO4 | 56.3 | 60 | 63.7 | 66.7 | 67.8 | 70.1 | 74.5 | ||||
氰化钾 | KCN | 50 | ||||||||||
重铬酸钾 | K2Cr2O7 | 4.7 | 7 | 12.3 | 18.1 | 26.3 | 45.6 | 73 | ||||
砷酸二氢钾 | KH2AsO4 | 19 | ||||||||||
磷酸二氢钾 | KH2PO4 | 14.8 | 18.3 | 22.6 | 28 | 35.5 | 50.2 | 70.4 | 83.5 | |||
铁氰化钾 | K3Fe(CN)6 | 30.2 | 38 | 46 | 53 | 59.3 | 70 | 91 | ||||
K4Fe(CN)6 | 14.3 | 21.1 | 28.2 | 35.1 | 41.4 | 54.8 | 66.9 | 71.5 | 74.2 | |||
氟化钾 | KF | 44.7 | 53.5 | 94.9 | 108 | 138 | 142 | 150 | ||||
甲酸钾 | KHCO2 | 313 | 337 | 361 | 398 | 471 | 580 | 658 | ||||
碳酸氢钾 | KHCO3 | 22.5 | 27.4 | 33.7 | 39.9 | 47.5 | 65.6 | |||||
磷酸一氢钾 | K2HPO4 | 150 | ||||||||||
硫酸氢钾 | KHSO4 | 36.2 | 48.6 | 54.3 | 61 | 76.4 | 96.1 | 122 | ||||
KOH | 95.7 | 103 | 112 | 126 | 134 | 154 | 178 | |||||
碘酸钾 | KIO3 | 4.6 | 6.27 | 8.08 | 10.3 | 12.6 | 18.3 | 24.8 | 32.3 | |||
碘化钾 | KI | 128 | 136 | 144 | 153 | 162 | 168 | 176 | 192 | 198 | 206 | |
硝酸钾 | KNO3 | 13.9 | 21.9 | 31.6 | 45.3 | 61.3 | 85.5 | 106 | 138 | 167 | 203 | 245 |
亚硝酸钾 | KNO2 | 279 | 292 | 306 | 320 | 329 | 348 | 376 | 390 | 410 | ||
草酸钾 | K2C2O4 | 25.5 | 31.9 | 36.4 | 39.9 | 43.8 | 53.2 | 63.6 | 69.2 | 75.3 | ||
高氯酸钾 | KClO4 | 0.76 | 1.06 | 1.68 | 2.56 | 3.73 | 7.3 | 13.4 | 17.7 | 22.3 | ||
高碘酸钾 | KIO4 | 0.17 | 0.28 | 0.42 | 0.65 | 1 | 2.1 | 4.4 | 5.9 | |||
KMnO4 | 2.83 | 4.31 | 6.34 | 9.03 | 12.6 | 22.1 | ||||||
过二硫酸钾 | K2S2O8 | 4.7 | ||||||||||
磷酸钾 | K3PO4 | 81.5 | 92.3 | 108 | 133 | |||||||
硒酸钾 | K2SeO4 | 107 | 109 | 111 | 113 | 115 | 119 | 121 | 122 | |||
硫酸钾 | K2SO4 | 7.4 | 9.3 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 22.9 | 24.1 | ||
四苯硼钾 | KBC24H20 | 1.8×10 | ||||||||||
硫氰酸钾 | KSCN | 177 | 198 | 224 | 255 | 289 | 372 | 492 | 571 | 675 | ||
硫代硫酸钾 | K2S2O3 | 96 | 155 | 175 | 205 | 238 | 293 | 312 | ||||
钨酸钾 | K2WO4 | 51.5 | ||||||||||
三氯化金 | AuCl3 | 68 | ||||||||||
三碘化金 | AuI3 | 1.295×10 | ||||||||||
草酸金(V) | Au2(C2O4)5 | 0.258 |
钪
物质 | 化学式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
草酸钪 | Sc2(C2O4)3·6H2O | 6×10 | ||||||||||
硫酸钪 | Sc2(SO4)3·5H2O | 54.6 |
镧、锂、硫、镥、铝
物质 | 化学式 | 0°C | 10°C | 20°C | 30°C | 40°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
乙酸镧 | La(C2H3O2)3·H2O | 16.9 | ||||||||||
溴酸镧 | La(BrO3)3 | 98 | 120 | 149 | 200 | |||||||
碘酸镧 | La(IO3)3 | 4.575×10 | ||||||||||
钼酸镧 | La2(MoO4)3 | 2.473×10 | ||||||||||
硝酸镧 | La(NO3)3 | 100 | 136 | 168 | 247 | |||||||
硒酸镧 | La2(SeO4)3 | 50.5 | 45 | 45 | 45 | 45 | 18.5 | 5.4 | 2.2 | |||
硫酸镧 | La2(SO4)3 | 3 | 2.72 | 2.33 | 1.9 | 1.67 | 1.26 | 0.91 | 0.79 | 0.68 | ||
钨酸镧 | La2(WO4)3·3H2O | 6.06 | ||||||||||
乙酸锂 | LiC2H3O2 | 31.2 | 35.1 | 40.8 | 50.6 | 68.6 | ||||||
叠氮化锂 | LiN3 | 61.3 | 64.2 | 67.2 | 71.2 | 75.4 | 86.6 | 100 | ||||
苯甲酸锂 | LiC7H5O2 | 38.9 | 41.6 | 44.7 | 53.8 | |||||||
溴酸锂 | LiBrO3 | 154 | 166 | 179 | 198 | 221 | 269 | 308 | 329 | 355 | ||
溴化锂 | LiBr | 143 | 147 | 160 | 183 | 211 | 223 | 245 | 266 | |||
Li2CO3 | 1.54 | 1.43 | 1.33 | 1.26 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 | |||
氯酸锂 | LiClO3 | 241 | 283 | 372 | 488 | 604 | 777 | |||||
氯化锂 | LiCl | 69.2 | 74.5 | 83.5 | 86.2 | 89.8 | 98.4 | 112 | 121 | 128 | ||
铬酸锂 | Li2CrO4.2H2O | 142 | ||||||||||
重铬酸锂 | Li2Cr2O7.2H2O | 151 | ||||||||||
磷酸二氢锂 | LiH2PO4 | 126 | ||||||||||
氟化锂 | LiF | 0.16 | ||||||||||
氟硅酸锂 | Li2SiF6.2H2O | 73 | ||||||||||
甲酸锂 | LiHCO2 | 32.3 | 35.7 | 39.3 | 44.1 | 49.5 | 64.7 | 92.7 | 116 | 138 | ||
亚磷酸氢锂 | Li2HPO3 | 4.43 | 9.97 | 7.61 | 7.11 | 6.03 | ||||||
氢氧化锂 | LiOH | 12.7 | 12.7 | 12.8 | 12.9 | 13.0 | 13.3 | 13.8 | 15.3 | 17.5 | ||
碘化锂 | LiI | 151 | 157 | 165 | 171 | 179 | 202 | 435 | 440 | 481 | ||
钼酸锂 | Li2MoO4 | 82.6 | 79.5 | 79.5 | 78 | 73.9 | ||||||
硝酸锂 | LiNO3 | 53.4 | 60.8 | 70.1 | 138 | 152 | 175 | |||||
亚硝酸锂 | LiNO2 | 70.9 | 82.5 | 96.8 | 114 | 133 | 177 | 233 | 272 | 324 | ||
草酸锂 | Li2C2O4 | 8 | ||||||||||
高氯酸锂 | LiClO4 | 42.7 | 49 | 56.1 | 63.6 | 72.3 | 92.3 | 128 | 151 | |||
高锰酸锂 | LiMnO4 | 71.4 | ||||||||||
磷酸锂 | Li3PO4 | 3.821×10 | ||||||||||
硒化锂 | Li2Se | 57.7 | ||||||||||
亚硒酸锂 | Li2SeO3 | 25 | 23.3 | 21.5 | 19.6 | 17.9 | 14.7 | 11.9 | 11.1 | 9.9 | ||
硫酸锂 | Li2SO4 | 36.1 | 35.5 | 34.8 | 34.2 | 33.7 | 32.6 | 31.4 | 30.9 | |||
酒石酸锂 | Li2C4H4O6 | 42 | 31.8 | 27.1 | 26.6 | 27.2 | 29.5 | |||||
硫氰酸锂 | LiSCN | 114 | 131 | 153 | ||||||||
钒酸锂 | LiVO3 | 2.5 | 4.82 | 6.28 | 4.38 | 2.67 | ||||||
二氧化硫 | SO2 | 9.4 | ||||||||||
氢氧化镥(III) | Lu(OH)3 | 1.164×10 | ||||||||||
硫酸镥(III) | Lu2(SO4)3·8H2O | 57.9 | ||||||||||
AlCl3 | 43.9 | 44.9 | 45.8 | 46.6 | 47.3 | 48.1 | 48.6 | 49 | ||||
氟化铝 | AlF3 | 0.56 | 0.56 | 0.67 | 0.78 | 0.91 | 1.1 | 1.32 | 1.72 | |||
硝酸铝 | Al(NO3)3 | 60 | 66.7 | 73.9 | 81.8 | 88.7 | 106 | 132 | 153 | 160 | ||
高氯酸铝 | Al(ClO4)3 | 122 | 128 | 133 | ||||||||
硫酸铝 | Al2(SO4)3 | 31.2 | 33.5 | 36.4 | 40.4 | 45.8 | 59.2 | 73 | 80.8 | 89 | ||
Al(OH)3 | 0.0001 |