-
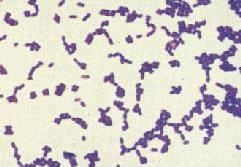
革兰氏阳性细菌 编辑
革兰氏阳性菌包含细菌中的一个大门——厚壁菌门(Firmicutes),包括一些著名的属,如芽孢杆菌(Bacillus)、李斯特氏菌(Listeria)、葡萄球菌(Staphylococcus)、链球菌(Streptococcus)、肠球菌(Enterococcus)和梭菌(Clostridium)。此外厚壁菌门还包括了柔膜菌纲(Mollicutes),如支原体(Mycoplasma),它们不能被革兰氏法染色,但与这些革兰氏阳性种类相关。
放线菌是另一大类革兰氏阳性菌,根据DNA中鸟嘌呤(G)和胞嘧啶(C)的含量,放线菌被称为高G+C革兰氏阳性菌,而厚壁菌被称为低G+C革兰氏阳性菌。如果细胞的第二层膜是衍生特征,这两类革兰氏阳性菌可能是细菌基部的分支,否则它们可能组成关系相对较近的单系群。它们被认为可能是古细菌和真核生物的祖先,因为它们都缺乏第二层膜,并且具有一些生化上的相似性,比如含有固醇类。 此外,尽管恐球菌-栖热菌(DeiNOcoccus-Thermus)类细菌结构上类似革兰氏阴性菌,但也可被染成革兰氏阳性。
革兰氏染色法,能够把细菌分为两大类:采用这种染色方法,是先用龙胆紫(亦称结晶紫)来染病菌,所有细菌都染成了紫色,然后再涂以革兰氏碘液,来加强染料与菌体的结合,再用95%的酒精来脱色20~30秒钟,有些细菌不被脱色,仍保留紫色,有些细菌被脱色变成无色,最后再用复红或沙黄复染1分钟,结果已被脱色的细菌被染成红色,未脱色的细菌仍然保持紫色,不再着色,这样,凡被染成紫色的细菌称为革兰氏阳性菌(G﹢菌);染成红色的称为革兰氏阴性菌(Gˉ菌)。革兰氏染色法的意义就在于鉴别细菌,把众多的细菌分为两大类,革兰氏阳性菌和革兰氏阴性菌。大多数化脓性球菌都属于革兰氏氏阳性菌,它们能产生外毒素使人致病,而大多数肠道菌多属于革兰氏阴性菌,它们产生内毒素,靠内毒素使人致病。常见的革兰氏阳性菌有:葡萄球菌、链球菌、肺炎双球菌、炭疽杆菌、白喉杆菌、破伤风杆菌等;常见的革兰氏阴性菌有痢疾杆菌、伤寒杆菌、变形杆菌、绿脓杆菌、百日咳杆菌、霍乱弧菌及脑膜炎双球菌等。在治疗上,大多数革兰氏阳性菌都对青霉素敏感;而革兰氏阴性菌则对青霉素不敏感,而对链霉素、氯霉素等敏感。所以首先区分病原菌是革兰氏阳性菌还是阴性 菌,在选择抗生素方面意义重大。
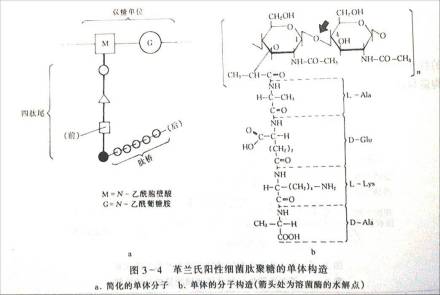
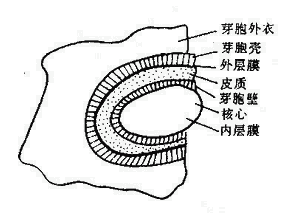
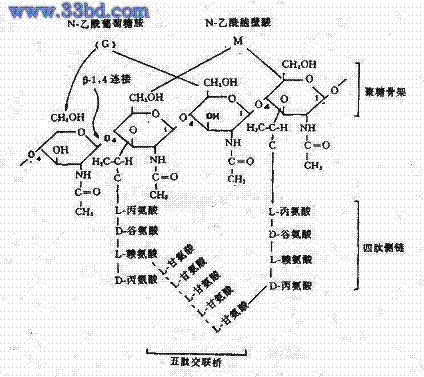
革兰氏染色的结果取决于细菌细胞壁的结构即革兰氏染色原理为:G﹢菌:细胞壁厚,肽聚糖网状分子形成一种透性障,当乙醇脱色时,肽聚糖脱水而孔障缩小,故保留结晶紫-碘复合物在细胞膜上。呈紫色。
Gˉ菌:肽聚糖层薄,交联松散,乙醇脱色不能使其结构收缩,其脂含量高,乙醇将脂溶解,缝隙加大,结晶紫-碘复合物溶出细胞壁,沙黄复染后呈红色。
随着抗生素滥用现象不断加剧,临床细菌耐药问题日趋严重。在近日闭幕的“抗生素治疗革兰氏阳性细菌现状与进展学术研讨会”上,张致平、朱士俊、罗慰慈等专家再次发出警示。
自上世纪90年代以来,革兰氏阳性球菌在医院感染病原体中比例显著上升,并成为当今院内感染中最重要的病原体。据中国医科院医药生物技术所张致平教授报告分析,这些病原体接触抗生素发生变异并获得耐药性的机制体现在四方面:产生抗生素酶,灭活抗生素;作用靶位变异,不应答药物;外膜通透性改变,阻断药物进入;增强外排,加速泵出进入菌体内药物。 北京大学临床药理研究所副所长肖永红教授认为,目前,我国此类感染以耐甲氧西林葡萄球菌、耐环大内酯肺炎链球菌、耐青霉素肺炎链球菌为主,比例均达70%以上。对此,大部分抗生素已失去效用。更令人担忧的是,我国学者已从动物肌肉内分离到耐万古霉素肠球菌。
专家指出,在加紧研发新治疗药物的同时,必须大力摒除临床上不对症应用、长时间应用抗生素,以及在动物饲料中大量添加抗生素等行为。
细菌表面呈现系统是微生物表面呈现系统的一个重要分支,它是继噬菌体表面呈现系统之后发展起来的又一呈现系统,在一定程度上可以说是噬菌体呈现系统的替代途径,至少可以说是对噬菌体呈现系统的补充。其基本策略也是将外源蛋白或多肽与细菌表面蛋白融合或嵌合并活性表达于细菌表面。 自从发现大肠杆菌外膜蛋LamB、OmpA和PhoE能够作为外源蛋白的表面呈现载体以来,该技术得到了迅猛发展,许多研究结果说明脂蛋白、菌毛蛋白、鞭毛蛋白等都可作为呈现载体。而且不仅革兰氏阴性菌可用以表面呈现,革兰氏阳性菌也可用以表面呈现。该技术已成为研究的热点,在微生物学、分子生物学、疫苗学等多个领域的基础和应用研究中得到了广泛应用。
革兰氏阳性菌胞膜外有一层较厚且坚韧的细胞壁,膜蛋白难以显露,一般认为不适合表面呈现。但最近的一些研究发现有些细胞表面结合蛋白,如金黄色葡萄球菌蛋白A、化脓链球菌M6蛋白等的C末端具有较高的同源性,可以通过一段疏水区与含肽聚糖的细胞壁结合而锚定于细菌表面,而其N末端部分则允许外源蛋白的插入或替换,从而实现表面呈现。通过对spA透膜锚定机制的研究发现,spA由信号肽、lgG结合区和C末端的表面结合区组成,而其C末端结合区由一个带电的重复序列区、许多革兰氏阳性菌表面结合蛋白相同的含有LPXTG结构的区段、疏水的锚定区和一个短的带电尾巴RREL组成,后三部分对于结合在细菌表面是必须的,伴随着LPXTG结构中T-G间肽键的断裂而共价结合到细胞壁上。
许多革兰氏阳性菌的表面结合蛋白的C末端序列同源性很高,提示它们可能以相同或相似的机制结合到细胞壁上。葡萄球菌表面呈现系统是利用spA的C末端锚定区,用外源蛋白取代IgG结合区片段,基因以质粒形式存在于宿主细胞内,融合蛋白表达并呈现在细菌表面。在链球菌表面呈现系统中,则是利用化脓链球菌M6蛋白相似的C末端区域,外源基因通过同源重组机制整合在染色体上而实现表面呈现。最近化脓链球菌M6蛋白在乳酸杆菌表面获得了表达,提示将来可以用乳酸杆菌作为表面呈现系统的宿主菌。卡介苗(BCG)是一种减毒的牛结核杆菌,它通常是作为结核病的预防疫苗,研究发现它对于开发多价疫苗具有明显的优势。在卡介苗表面呈现系统中,载体蛋白是结核杆菌的膜结合脂蛋白,目前已发现有两种蛋白可用作呈现载体,如Mtb19、Mtb39,通过将靶蛋白与膜结合脂蛋白的相应膜结合区融合表达而实现外源蛋白的表面呈现。 用该系统成功呈现了螺旋体外膜蛋白A(OspA),用重组菌去免疫小鼠,所诱发的免疫应答水平明显高于用BCG胞质表达OspA或分泌表达的融合蛋白免疫所诱发的免疫应答水平,抗体效价比可高达100-1000倍。提示表面呈现蛋白的免疫提呈方式可能不同于一般的抗原,效率更高,再者脂蛋白的免疫佐剂作用也利于诱发高水平的免疫应答。球杆菌也被用于表面呈现的研究,在该系统中是将外源蛋白与细胞壁结合的自溶素修饰蛋白CwbA融合而获表面呈现,用呈现的伪结核病耶氏菌侵袭素免疫动物,可以诱发特异的抗体反应。在乳球菌中,尝试将破伤风毒素与细胞表面结合的蛋白酶PrtP融合进行呈现,但没有获得成功。