-
单糖 编辑
按碳原子数目,单糖可分为丙糖、丁糖、戊糖、己糖等。自然界的单糖主要是戊糖和己糖。根据构造,单糖又可分为醛糖和酮糖。多羟基醛称为醛糖,多羟基酮称为酮糖。例如,葡萄糖为己醛糖,果糖为己酮糖。单糖中最重要的与人们关系最密切的是葡萄糖等。常见的单糖还有果糖、半乳糖、核糖和脱氧核糖等 。
单糖的环状结构
在溶液中,含有4个以上碳原子的单糖主要以环状结构存在。
单糖分子中的羟基能与醛基或酮基可逆缩合成环状的半缩醛
单糖的命名是依据母体单糖的开链结构名称来命名的。单糖母体可以采用系统命名,根据糖的碳原子数命名为三碳糖(丙糖)、四碳糖(丁糖)、五碳糖(戊糖)、六碳糖(己糖)等;糖的构型则用俗名的前缀标示,如D-葡萄-己糖(D-gluco-hexose)。相比于糖的系统命名,糖的俗名更常用,C3~C6的糖多有俗名。2、高碳糖的命名
对于含有多于4个手性中心的醛糖、酮糖,在命名时应在主干词前添加两个或更多的构型前缀。最先书写的应该是离C-1最远的部分(可能少于4个原子),糖的构型取决于编号最高的手性碳的构型。
环状单糖的命名
大多数的单糖以五元环、六元环环状半缩醛或半缩酮的形式存在。五元环状半缩醛或半缩酮糖称为呋喃糖,六元环的则称为吡喃糖。命名时在原糖名前加“呋喃”或“吡喃”(注:按习惯命名,此与IUPAC的英文命名中的构词方式不同),如呋喃葡萄糖(glucofuranose)或吡喃葡萄糖(glucopyranose)。由闭环所形成的新手性中心称为端基中心,两个立体异构体称为端基异构体,并根据端基中心环外羟基与标示构型羟基的关系用α或β标示。α异构体是指端基中心上的环外氧原子与构型标示原子上的氧原子在Fischer投影式中呈顺式(cis)的异构体,β异构体是呈反式(trans)的异构体,标示端基异构体符号“α”或“β”用连接号写在标示构型的符号“D”或“L”之前。
1、环状结构的Fischer投影式表示法
如果要用Fischer投影式来表示一个环形糖,可以用一根长键连接具体的醇羟基与端基碳。
2、环状结构的Haworth表示法
将吡喃糖写成六元环的形状,环与纸面近乎垂直,观察时从正上方垂直向下看,使环上氧在后方,C-1在右侧,因此离观察者近的一边应位于远的一侧的下方。为更清晰地标示透视的情况,离观察者近的一侧的键通常加粗。在Fischer投影式中朝右的基团在Haworth透视式中在环平面以下;左侧的则在环平面以上。其他一些糖的Haworth式可类似表示。
Haworth式的六元环并非一个平面,而是如环己烷一样呈椅式构象存在。为了清晰标示吡喃糖的构象,Haworth式写成椅式构象,碳上的氢原子时常被省略。
3、环状结构的Mills表示法
单糖的环状结构也可用Mills写法,特别是当出现额外的环结构时,结构式采用Mills式更清晰。Mills式的表示法是将主要的半缩醛环画在纸平面上,虚线键所连取代基表示指向纸平面里的基团,加粗键所连的基团则指向纸平面以外。
环状单糖的命名
物理性质
单糖通常是易溶于水的无色晶体,大多有吸湿性。难溶于乙醇,不溶于乙醚。单糖有旋光性,多于四个碳的单糖的溶液有变旋现象。
化学性质
四个碳以上的单糖主要以环状结构形式存在,但在溶液中可以以开链结构反应。因此,单糖的化学反应有的以环式结构进行,有的以开链结构进行。
1.差向异构
葡萄糖用稀碱液处理时,会部分转变为甘露糖和果糖,成为复杂的混合物。这变化是通烯醇式中间体来完成的。
D-果糖、D-甘露糖和D-葡萄糖的C-3.C-4,C-5和C-6的结构完全相同,只有C-1和C-2的结构不同,但是它们的C-1,C-2的结构互变成烯醇型时,其结构完全相同的。因此,不单是D-葡萄糖,而D-果糖或D-甘露糖在稀碱催化下,都能互变为三者的混合物。
在含有多个手性碳原子的具有旋光性的异构体之间,凡只有一个手性碳原子的构型不同时,互称为差向异构体。D-葡萄糖和D-甘露糖就是C-2差向异构体。因此,用稀碱处理D-葡萄糖得到D-葡萄糖、D-果糖三种物质的平衡混合物的反应叫做差向异构化。
2.氧化作用
单糖无论是醛糖或酮糖都可与弱的氧化剂叶伦试剂、斐林试剂和本尼迪特试剂作用,生成金属或金属的低价氧化物。上述三种试剂都是碱性的弱氧化剂。单糖在碱性溶液中加热,生成复杂的混合物。
单糖易被碱性弱氧化剂氧化说明它们具有还原性,所以把它们叫做还原糖。
单糖在酸性条件下氧化时,由于氧化剂的强弱不同,单糖的氧化产物也不同。例如,葡萄糖被溴水氧化时,生成葡萄糖酸;而用强氧化剂硝酸氧化时,则生成葡萄糖二酸。
溴水氧化能力较弱,它把醛糖的醛基氧化 为羧基。当醛糖中加入溴水,稍加热后,溴水的棕色即可褪去,而酮糖则不被氧化,因此可用溴水来区别醛糖和酮糖。
3.成苷作用
单糖环状半缩醛结构中的半缩醛羟基与另一分子醇或羟基作用时,脱去一分子水而生成缩醛。糖的这种缩醛称为糖苷。例如α-和β-D-吡喃葡萄糖的混合物,在氯化氢催化下同甲醇反应,脱去一分子水,生成α-和β-D-甲基吡喃葡萄糖苷的混合物。
α-和β-D-吡喃葡萄混合液 β-D-甲基吡喃葡萄糖苷 α-D-甲基吡喃葡萄糖苷,苷由糖和非糖部分组成。非糖部分称为糖苷配基或苷元。糖和糖苷配基脱水后通过过“氧桥”连接,这种键称为苷键。由于单糖的环式结构有α-和β-两种构型,所以可生成α-和β-两种没构型的苷。天然苷多为β-构型。苷的名称是按其组成成分而命名的,并指出苷键和糖的构型。天然苷常按其来源而用俗名。
糖苷结构中已没有半缩醛羟基,在溶液中不能再转变成开链的醛式结构,所以糖工苷无还原性,也没有变旋现象。糖苷在中性或碱性环境中较稳定,但在酸性溶液中或在酶的作用下,则水解生成糖和非糖部分。
糖苷是中草药的有效成分之一,多为无色、无臭、有苦涩味的固体,但黄酮苷和蒽醌苷为黄色。
苷中含有糖部分,所以在水中有一定的溶解性。苷类都有旋光性,天然苷多为左旋体。
4.成酯作用
单糖分子中含多个羟基,这些羟基能与酸作用生成酯。人体内的葡萄糖在酶作用下生成葡萄糖磷酸酯,如1-磷酸吡喃葡萄糖和6-磷酸吡喃葡萄糖等。
单糖的磷酸酯在生命过程中具有重要意义,它们是人体内许多代谢的中间产物。
5.成脎反应
单糖分子与三分子苯肼作用,生成的产物叫做糖脎。例如葡萄糖与过量苯肼作用,生成葡萄糖脎。
无论是醛糖还是酮糖都能生成糖脎,成脎反应可以看作是α-羟基醛或α-羟基酮的特有反应。
糖脎是难溶于水的黄色晶体。不同的脎具有特征的结晶形状和一定的熔点。常利用糖脎和这些性质来鉴别不同的糖。
成脎反应只在单糖分子的C-1和C-2上发生,不涉及其它碳原子,因此除了C-1和C-2以外碳原子构型相同的糖,都可以生成相同的糖脎。例如:D-葡萄糖和D-果糖都 生成相同的脎。
6.还原反应
单糖可以被还原成相应的糖醇(Sugar alcohol)。
D-葡萄糖被还原成D-葡萄糖醇,又称山犁醇(D-Sorbitol)。
糖醇主要用于食品加工业和医药,山犁醇添加到糖果中能延长糖果的货架期,因为它能防止糖果失水。用糖精处理的果汁中一般都有后味,添加山犁醇后能去除后味。人体食用后,山犁醇在肝中又会转化为果糖 。
自然界已发现的单糖主要是戊糖和己糖。常见的戊糖有D-(-)-核糖、D-(-)-2-脱氧核糖、D-(+)-木糖和L-(+)-阿拉伯糖。它们都是醛糖,以多糖或苷的形式存在于动植物中。常见的己糖有D-(+)-葡萄糖、D-(+)-甘露糖、D-(+)-半乳糖和D-(-)-果糖,后者为酮糖。己糖以游离或结合的形式存在于动植物中。
核糖
核糖以糖苷的形式存在于酵母和细胞中,是核 酸以及某些酶和维生素的组成成全分。核酸中除核糖外,还有2-脱氧核糖(简称为脱氧核糖)。
核糖和脱氧核糖的环为呋喃环,故称为呋喃糖。
β-D -(-)-呋喃核糖 β-D-(-)-脱氧呋喃核糖核酸中的核糖或脱氧核糖C-1上的β-苷键结合成核糖核苷或脱氧核糖核苷,统称为核苷。
核苷中的核糖或脱氧核糖,再以C-5或C-3上的羟基与磷酸以酯键结合即成为核苷酸。含核糖的核苷酸统称为核糖核苷酸,是RNA的基本组成单位;含脱氧核糖的核苷酸统称为脱氧核糖核苷酸,是DNA的基本组成单位。
葡萄糖
D-(+)-葡萄糖在自然界中分布极广,尤以葡萄中含量较多,因此叫葡萄糖。葡萄糖也存在于人的血液中(389-555umol/L)叫做血糖。糖尿病患者的尿中含有葡萄糖,含糖量随病情的轻重而不同。葡萄糖是许多糖如蔗糖、麦芽糖、乳糖、淀粉、糖原、纤维素等的组成单元。
葡萄糖是无色晶体或白色结晶性粉末,熔点146℃,易溶于水,难溶于酒精,有甜味。天然的葡萄糖具有右旋性,故又称右旋糖。
在肝脏内,葡萄糖在酶作用下氧化成葡萄糖醛酸,即葡萄糖末端上的羟甲基被氧化生成羧基。
葡萄糖醛酸在肝中可与有毒物质如醇、酚等结合变成无毒化合物由尿排出体外,可达到解毒作用。
半乳糖
半乳糖与葡萄糖结合成乳糖,存在于哺乳动物的乳汁中,脑髓中有些结构复杂的脑苷脂中也含有半乳糖。
半乳糖是己醛糖,是葡萄糖的非对映体。两者不同之处仅在于C-4上的构型正好相反,故两者为C-4的差向异构体。半乳糖也有环状结构,C-1上也有α-和β-两种构型。
α-D-吡喃半乳糖β-D-吡喃半乳糖
半乳糖是无色晶体,熔点165-166℃。半乳糖有还原性,也有变旋现象,平衡时的比旋光度为+83.3°。
人体内的半乳糖是摄入食物中乳糖的水解产物。在酶的催化下半乳糖能转变为葡萄糖。
半乳糖的一些衍生物广泛分布于植物界。例如,半乳糖醛酸是植物粘液的主要成分;石花菜胶9也叫琼脂)的主要组成是半乳糖衍生物的高聚体。
果糖
D-果糖以游离状态存在于水果和蜂蜜中,是蔗糖的一个组成单元,在动物的前列腺和精液中也含有相当量的果糖。
果糖为无色晶体,易用溶于水,熔点为105℃。D-果糖为左旋糖,也有变旋现象,平衡时的比旋光度为-92°。这种平衡体系是开链式和环式果糖的混合物。
β-D-(-)-吡喃果糖 β-D-(-)-呋喃果糖
果糖在游离状态下时,主要以吡喃环形式存在:在结合状态时则多以呋喃环形式存在。
果糖也可以形成磷酸酯,体内有果糖-6-磷酸酯,(用F-6- 表示)和果糖-1,6-二磷酸(用F-1,6-二 表示)。
果糖磷酸酯 体内糖代谢的重要中间产物,在糖代谢中有其重要的地位。F-1,6-二 在酶的催化下,可生成甘油醛-3-磷酸酯和二羟基的丙酮磷酸酯。
体内通过此反应将己糖变为丙糖,这是糖代谢过程中的一个中间步骤。此反应类似于羟醛缩合反应的逆反应。
氨基糖
自然界的氨基糖是己醛糖分子中C-2上的羟基被氨基取代的衍生物。
β-D-氨基葡萄糖 β-D-氨基半乳糖
氨基糖常以结合状态存在于粘蛋白和糖蛋白中,但游离的氨基半乳糖对肝脏有毒性。
糖醛酸
糖醛酸(alduroic acid) 醛糖中距醛基最远的羟基被氧化成羧基而成的糖酸。天然存在的糖醛酸有D-葡萄糖,D-甘露糖和D-半乳糖衍生的3种己糖醛酸,它们分别是动物、植物和微生物多糖的重要组分,其中只有半乳糖醛酸可以游离状态存在于植物果实中。在动物体内,D-葡糖醛酸有解毒的功能。能和D-葡糖醛酸结合的配糖基种类很多,一般都是小分子化合物,包括酚类、芳香酸、脂肪酸、芳香烃等。通常配糖基与D-葡糖醛酸保持1∶1的比例,很少有例外。结合部位主要在肝脏。
脱氧糖
单糖的羟基被氢取代所构成的化合物。如D-2-脱氧核糖为DNA的成分;L-岩藻糖为一些糖蛋白的成分,它是L-6-脱氧半乳糖。
核苷二磷酸糖
核苷二磷酸糖(nucleoside diphosphate sugar)单糖与核苷二磷酸末端磷酸基用糖苷键连结构成的化合物。其中被活化的糖基参与许多代谢反应,特别是寡糖和多糖的生物合成。研究过的天然核苷二磷酸糖已有百多种,如核苷二磷酸葡糖就有UDP-葡糖、ADP-葡糖、CDP-葡糖、GDP-葡糖、TDP-葡糖等5种。尿苷二磷酸葡糖(uridine diphosphate glucose,UDPG)可作核苷二磷酸糖的代表。

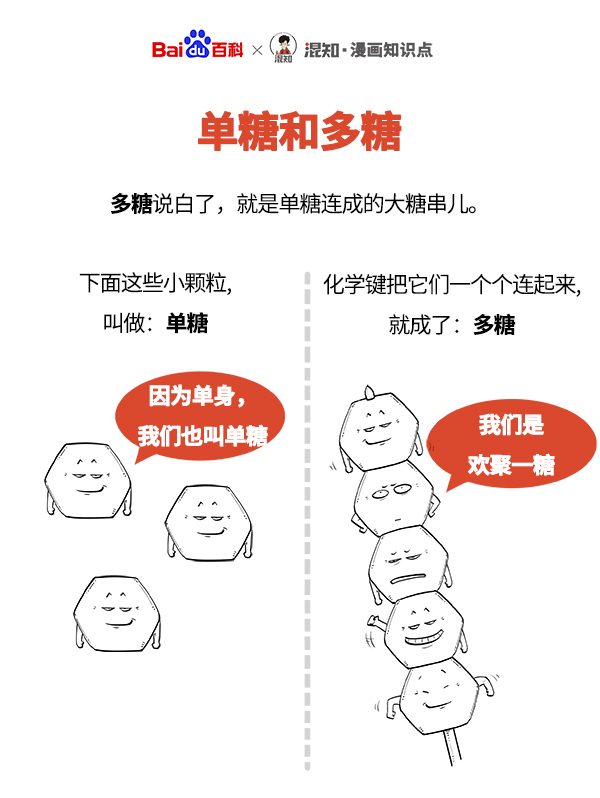 百科x混知:图解单糖和
百科x混知:图解单糖和









