-
疏水性 编辑
疏水性(hydrophobicity)
在化学里,疏水性指的是一个分子(疏水物)与水互相排斥的物理性质。
举例来说,疏水性分子包含有烷烃、油、脂肪和多数含有油脂的物质。
疏水性通常也可以称为亲脂性,但这两个词并不全然是同义的。即使大多数的疏水物通常也是亲脂性的,但还是有例外,如硅橡胶和碳氟化合物(FluorocARBon)。
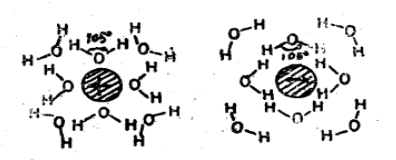
性质理论根据热力学的理论,物质会寻求存在于最低能量的状态,而氢键便是个可以减少化学能的办法。水是极性物质,并因此可以在内部形成氢键,这使得它有许多独别的性质。但是,因为疏水物不是电子极化性的,它们无法形成氢键,所以水会对疏水物产生排斥,而使水本身可以互相形成氢键。这即是导致疏水作用(这名称并不正确,因为能量作用是来自亲水性的分子)的疏水效应,因此两个不相溶的相态(亲水性对疏水性)将会变化成使其界面的面积最小时的状态。此一效应可以在相分离的现象中被观察到。 图2 疏水性相互作用示意图
图2 疏水性相互作用示意图
水的排列上的紊乱引起体系内熵的增加,并由此而减少自由能,使两个非极性区域间的接触稳定化,这种缔合作用称为疏水性键或疏水性相互作用。它是已知为疏溶剂性力的普遍现象中的一种特例。疏溶剂性力中以疏水性力为最大,因为在一般惰性溶剂中,水的表面张力最大。
在极有利于复合物形成的疏水性相互作用过程中,每一H2C…CH2—相互作用释放0.7千卡/克分子的自由能。生物大分子(例如酶)在其表面有非极性链。很多药物分子在其结构中也有非极性区域。上述两例中这些链可以是芳基或烷基。因此可以预期,疏水性力介入生物大分子——药物复合物的形成,而且可以达到可观的程度。疏水性力也发生于极性基团中,例如在瞟呤和嘧啶碱中。事实上对于某些酶已由实验所证明。
蛋白质肽链上各残基侧链对溶剂的相对亲水性是一个重要的特征参量。
超二级结构中各残基对溶剂的相对亲水性或疏水性的性质是超二级结构的一个重要结构特征。
在天然状态,构成蛋白质的疏水氨基酸残基多数是处在分子的内部,形成疏水内核,从而维系蛋白质的紧密三维结构。对于超二级结构这一局域空间结构的疏水特性的形成,疏水性的变化规律等都是有待解决的问题。超二级结构中疏水特性的揭示和了解,对蛋白质肽链的折叠规律的认识和预测有一定价值。国际上一些生物学家,近年来对这一工作开展了研究,并有文献报道。
首先,运用T.J.Richmond和F.M.Richards在1978年提出的方法对超二级结构中每一残基侧链对溶剂的亲水性进行计算。然后根据Hubbard和Blundell(1987)给出的判据进行判断。该判据是国际上比较通用的一种判据。如果残基侧链对溶剂相对接触面积小于7%,那么该残基被称为疏水性的,在疏水性模式中用“i”表示;如果残基侧链对溶剂相对接触面积大于7%,则称该残基为溶剂亲水性的,在疏水性模式中用“o”表示示。疏水性上限值的确定是因为当氨基酸相对溶剂接触面积小于7%时,则亲水性质类同,几乎不变化。这样便计算出各类型超二级结构单元疏水性模式。从中可以得到超二级结构这一段肽链上每个残基疏水性和构象的关系,以及构象和氨基酸序列模式的关系。
在药物分子中大都会有非极性部分,即只由碳氢原子组成的部分,在受体分子中含有非极性氨基酸残基,如苯丙氨酸、缬氨酸、亮氨酸、异亮氨酸,这些氨基酸残基的侧链在形成蛋白质的立体结构时,可能遇到一起形成活性部位的非极性区,称为疏水袋(hy-drophobic pocket)。在体内,药物的非极性部分和受体的非极性区的表面均为有序排列的水分子所包围。当药物与受体接近到一定程度时,由于中间空间的缩小,将有序排列的水分子排挤出去。发生去水合现象(desolvation),这样便使系统的熵值增高,由此使系统的自由能降低,而成为较稳定的状态。这种自由能的降低是维持药物与受体形成复合物的力,称之为疏水性结合(hydrophobic binding),参见图3。
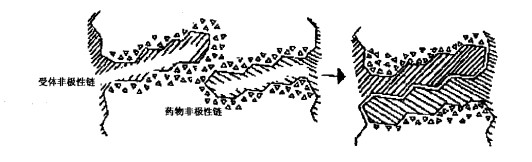 图3 疏水性相互作用示意图
图3 疏水性相互作用示意图
疏水性结合力的含义是不明确的,因此,这种作用力的强度没有明确的计算方法,但它在药物与受体相互作用中几乎是普遍存在的。据估算,两个次甲基间的疏水性作用可释放出0.7kcal/mol的能量,尽管很弱,但当有多个相当于次甲基间的疏水性结合时,其作用力仍是可观的。
超疏水性物质,如荷叶,具有极难被水沾湿的表面,其水在其表面的接触角超过150°,滑动角小于20°。
理论
气体环绕的固体表面的液滴。接触角θ,是由液体在三相(液体、固体、气体)交点处的夹角。
1805年,托马斯·杨通过分析作用在由气体环绕的固体表面的液滴的力而确定了接触角θ。
气体环绕的固体表面的液滴,形成接触角θ。如果液体与固体表面微结构的凹凸面直接接触,则此液滴处于Wenzel状态;而如果液体只是与微结构的凸面接触,则此液滴处于Cassie-Baxter状态。
其中: 固体和气体之间的表面张力 = 固体和液体之间的表面张力 = 液体和气体之间的表面张力,θ可以用接触角测量计来测量。
Wenzel确定了当液体直接接触微结构化的表面时,θ角会转变为θW *
cosθW * = rcosθ 其中,r为实际面积与投影面积的比率。Wenzel的方程显示了微结构化一个表面将会放大表面张力。疏水性表面(具有大于90°的接触角)在微结构化之后会变得更加疏水,其新的接触角将比原来增大。然而,一个亲水性表面(具有小于90°的接触角)在微结构化之后却会变得更加亲水,其新的接触角将比原来减小。
Cassie和Baxter发现如果液体悬浮在微结构表面,θ角将会变为θB *
cosθB * = φ(cos θ + 1)– 1 其中,φ为固体与液体接触面积的比例。在Cassie-Baxter状态下的液体比Wenzel状态下更具有运动性。
通过用以上两个方程计算出的新接触角,我们可以预测Wenzel状态或Cassie-Baxter状态是否应该存在。由于有自由能最小化的限制,预测出具有更小的新接触角的状态就会更可能存在。从数学上来说,要使Cassie-Baxter状态存在,以下的不等式必须成立。
cos θ < (φ-1)/(r - φ))提出的一个判断Cassie-Baxter状态是否存在的替代标准是:1)接触线力克服液滴未被支撑部分的重力;2)微结构足够高从而阻止液滴接触微结构的基底(即凹面)。
接触角是静态测量疏水性的方法,接触角滞后和滑动角则对疏水性的动态测量法。接触角滞后是一种鉴定表面异质性的现象。当移液器将液体注到固体表面时,液体就会形成一定的接触角。随着注入液体的增加,液滴的体积会随之增加,接触角也会变大,但三相边界会保持固定直到液体突然溢出。在液体溢出前瞬间的接触角被称为前进接触角。回退接触角可以通过将液体从液滴中吸出来测量。随着液体被吸出,液滴的体积减小,接触角也减小,但三相边界同样保持固定直到被完全吸回。在液体被吸回瞬间的接触角被称为回退接触角。而前进接触角和回退接触角之间的差异就是接触角滞后,它被用来鉴定表面的异质性、粗糙性和运动性。非同质的表面会有能够阻碍接触线的区域。滑动角是另一种动态测量疏水性的方法:在固体表面放置一个液点,倾斜表面直到液滴开始滑动,此时的倾斜角即为滑动角。处于Cassie-Baxter状态的液滴通常会表现出比Wenzel状态更小的滑动角和接触角滞后。
研究和应用
许多在自然界中找到的超疏水性物质都遵循Cassie定律,而它在次微米尺度下可以和空气组成双相物质。莲花效应便是基于此一原理而形成的。仿生学上,超疏水性物质的例子有利用纳米科技中的naNOpin胶片(nanopin film)。