-
氧 编辑
中文名:氧
外文名:Oxygen
CAS登录号:7782-44-7
EINECS登录号:231-956-9
熔点:-218.79℃
沸点:-182.95℃
密度:1.404g/dm³
外观:无色、无臭、无毒、无味气体
闪点:421.9℃
应用:气焊、医疗用氧
安全性描述:S17;S45;S36/37/39;S26;S61
危险性符号:R8
危险性描述:O
UN危险货物编号:1072
原子序数:8
常见氧化态:-2,-1,0
构成单质:氧气(O2),臭氧(O3)等
原子量:15.9994(通常取16)
元素符号:O
周期:第二周期
区:p区
电子排布:2s2p
电负性:3.44(鲍林标度)
稳定同位素:O,O,O
把水放入电解槽中,加入氢氧化钠或氢氧化钾以提高水的电解度,然后通入直流电,水就分解为氧气和氢气。每制取一立方米氧气,同时获得两立方米氢气。用电解法制取一立方米氧气要耗电12~15千瓦时,与上述两种方法的耗电量(0.55~0.60千瓦时)相比,是很不经济的。所以,电解法不适用于大量制氧。另外同时产生的氢气如果没有妥善的方法收集,在空气中聚集起来,如与氧气混合,容易发生极其剧烈的爆炸。所以,电解法也不适用于家庭制氧。
| |
电解水 |
|
光合作用总反应式 |
|
电解硝酸银溶液 |
|
氟气与水的反应 |
|
电解熔融氧化铝 |
|
氧化铜高温分解 |
|
加热氧化汞 |
|
过氧化氢分解 |
|
硝酸的见光分解 |
|
次氯酸见光分解 |
|
臭氧的分解 |
|
过氧化氢和氯气的反应 |
|
氧元素占整个地壳质量的48.6%,是地壳中含量最多的元素,它在地壳中基本上是以氧化合物的形式存在的。每一千克的海水中溶解有2.8毫克的氧气,而海水中的氧元素差不多达到了89%。就整个地球而言,氧的质量分数为15.2%。无论是人、动物还是植物,他们的细胞都有类似的组成,其中氧元素占到65%的质量。 在空气中,氧的体积占20.9%。
氧虽对身体有益,但并非越多越好,氧气含量过高时也会发生氧中毒, 氧中毒主要分以下三种类型:
肺型氧中毒
类似支气管肺炎。其表现及通常的发展过程为:最初为类似上呼吸道感染引起的气管刺激症状,如胸骨后不适(刺激或烧灼感)伴轻度干咳,并缓慢加重;然后出现胸骨后疼痛,且疼痛逐渐沿支气管树向整个胸部蔓延,吸气时为甚;疼痛逐渐加剧,出现不可控制的咳嗽;休息时也伴有呼吸困难。在症状出现的早期阶段结束暴露,胸疼和咳嗽可在数小时内减轻。
脑型氧中毒
最初出现额、眼、鼻、口唇及面颊肌肉的纤维性颤动,也可累及手的小肌肉;面色苍白、有异味感。继而可有恶心、呕吐、眩晕、汗、流涎、上腹部紧张;也可出现视力丧失、视野缩小、幻视、幻听;还会有心动过缓、心悸、气哽、指(趾)端发麻、情绪反常(忧虑、抑郁、烦躁或欣悦)。接着出现极度疲劳、嗜睡、呼吸困难等。少数情况还可能发生虚脱。
眼型氧中毒
主要表现为视网膜萎缩。早产婴儿在恒温箱内吸氧时间过长,视网膜有广泛的血管阻塞、成纤维组织浸润、晶体后纤维增生,可因而致盲。
置耐压钢瓶内,在35℃以下保存。
来源
本品含O2不得少于99.5%(mL/mL)。
性状
本品为无色气体,无臭,无味,有强助燃力。
本品1容在常压20°C时,能在乙醇7容或水32容中溶解。
鉴别
本品能使炽红的木条突然发火燃烧。
检查
取甲基红指示液与溴麝香草酚蓝指示液各0.3mL,加水400mL,煮沸5分钟,放冷,分取各100mL,置甲、乙、丙3支比色管中,乙管中加盐酸滴定液(0.01mol/L)0.20mL,丙管中加盐酸滴定液(0.01mol/L)0.40mL,再在乙管中通本品2000mL(速度为每小时4000mL),乙管显出的颜色不得较丙管的红色或甲管的绿色更深。
一氧化碳
取甲、乙2支比色管,分别加微温的氨制硝酸银试液25mL,甲管中通本品1000mL(速度为每小时4000mL)后,与乙管比较,应同样澄清无色。
取甲、乙2支比色管,分别加5%氢氧化钡溶液100mL,乙管中加0.04%碳酸氢钠溶液1.0mL,甲管中通本品1000mL(速度为每小时4000mL)后,所显浑浊与乙管比较,不得更浓(0.01%)。
其他气态氧化物质
取新制的碘化钾淀粉溶液(取碳化钾0.5g,加淀粉指示液100mL溶解,即得)100mL,置比色管中,加醋酸1滴,通本品2000mL(速度为每小时4000mL)后,溶液应无色。
含量测定
仪器装置
如图: A、C为总容量约300mL的吸收器,B为适宜的塞子,D、E及I为细玻璃导管,F为刻度精密至0.1mL、容量为100mL的量气管主体,G为三通活塞,H为气体进出口,J为平衡瓶。临用前用橡胶管将吸收器与量气管连接,后者再与平衡瓶连接。
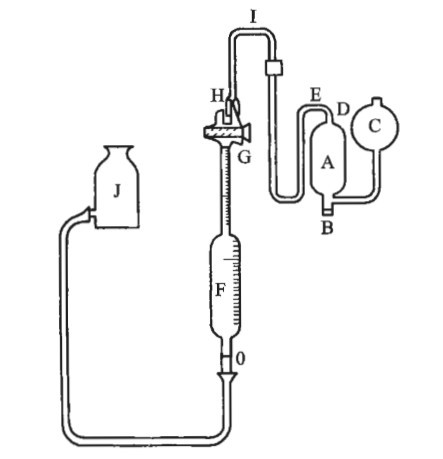
测定法
先将铜丝节(取直径约0.8mm的紫铜丝缠成直径约4mm的铜丝卷并剪成长约10mm的小节)装满于吸收器A中,用塞B塞紧,再将氨-氯化铵溶液(取氯化铵150g,加水200mL,随搅随小心加浓氨溶液200mL,混匀)导入,使充满A并部分留于C中,再将饱和氯化钠溶液注入平衡瓶J中,提高平衡瓶,使饱和氯化钠溶液充满F,多余溶液由H流出,转动G接通拱气管与吸收器,下降平衡瓶使吸收器中的溶液全部充满导管D、E、I和活塞G的入口,立即关闭活塞,如有气体和部分氨-氯化铵溶液进入量气管时,可提高平衡瓶转动活塞,使由H排出。
将供试品钢瓶接上减压阀(专供氧气用),后者出口接上橡胶管,小心微开钢瓶气阀,再开减压阀使氧气喷放1分钟后,调整至较弱的气流。
将橡胶管另一端连接在气体进出口H上,俟量气管装满本品后,关闭G并立即拆去气体进出口H上的橡胶管,静置数分钟,转动G接通气体进出口H,将平衡瓶徐徐升降(为防止吸入外界空气,应注意使平衡瓶内的液面略高于量气管内的液面),使量气管内的液面恰达刻度100mL处。转动G接通量气管与吸收器,举起平衡瓶使供试品进入吸收器A中,当饱和氯化钠溶液流经导管I并充满导管D时,关闭G并将吸收器A小心充分振摇5~10分钟,俟气体被吸收近完毕时(所剩者为氮或其他不被吸收的气体),转动G接通量气管与吸收器,降低平衡瓶,将剩余气体由吸收器转入量气管中,当氨-氯化铵溶液充满吸收器A并经导管D、E与I通过活塞G时,关闭活塞。
约5分钟后,调节平衡瓶的液面使量气管内的气体压力与大气压力一致,读出量气管内的液面刻度,算出供试品的含量。
为了检查氧是否完全被吸收,应重复上述操作,自“转动G接通量气管与吸收器,举起平衡瓶”起,依法操作,至剩余的气体体积恒定为止(二次差不大于0.05mL)。
检查或测定前,应先将供试品钢瓶在试验室温度下放置6小时以上。
类别
用于缺氧的预防和治疗。










